、现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸中,A上有气泡;②把C、D用导线连接后同时浸入稀硫酸中,D发生还原反应;③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。装置如图所示,根据上述情况,回答下列问题: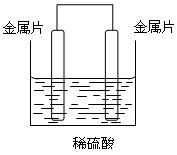
(1)四种金属的活动性顺序是_________________。
(2)在①中,金属片_____作负极;在②中,金属片_____上有气泡产生;在③中,金属片_____发生氧化反应。
(3)如果把B、D用导线连接后同时浸入稀硫酸中,则金属片_____上有气泡产生,该电极反应式为____________________。
(4)图示装置(金属片取①~③中的任一组)称为_________,它利用氧化还原反应将______能转化为______能。
在北方,常用乙二醇作内燃机的抗冻剂。某种合成乙二醇的路径如下图所示: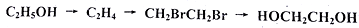
(1)按先后顺序,依次完成上图中每步反应的化学方程式:
①_______________________________________
②_______________________________________
③_______________________________________
(2)一定条件下,乙二醇可以被氧化为乙二醛,反应方程式为:______________________________
(3)CH2BrCH2Br有一同分异构体,其结构简式为:______________________________
家庭使用的天然气主要成分是甲烷,液化石油气的主要成分为丙烷。
(1)将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是________(写化学式,下同),在所有生成物中,和甲烷分子一样具有正四面体结构的物质是___________;
(2)液化石油气燃烧的主要化学方程式为__________________________;现有一套以天然气为原料的灶具,欲改为烧液化石油气,需要对灶具进行改装的措施是:_______________空气进量(填“增大”或“减小”);
(3)丙烷可以认为是丙烯的加成产物,也可以认为是某块的加成产物,该炔是_________(写结构简式);
(4)丙烯跟溴起加成反应,标准状况下,11.2L丙烯可以与________gBr2完全反应。
(1)请用系统命名法给下列有机物予以命名:
① ______________________
______________________
② ________________________
________________________
(2)请写出下列化合物的结构简式:
①3-乙基-2-戊醇 _______________________________
有NaHSO4、Ba(OH)2、NaHCO3三种溶液,已知其中两种溶液的物质的量浓度相同,且分别为另一种溶液的物质的量浓度的2倍;若先将 NaHSO4和NaHCO3溶液各100mL混合反应后,再加入Ba(OH)2溶液100mL,充分反应后,将生成的白色沉淀滤出,得300mL滤液,测得滤液中只含NaOH溶质,其物质的量的浓度为 0.9 mol·L-1(不考虑混合时引起的溶液体积的变化),试回答下列问题:
(1)写出Ba(OH)2溶液与过量NaHCO3溶液反应的离子方程式: ;
(2)写出NaHSO4溶液和NaHCO3溶液反应的离子方程式: ;
(3)通过分析,判断原Ba(OH)2、NaHSO4、NaHCO3三种溶液中哪两种溶液的物质的量浓度不可能相同?(填化学式)。
(4)题中NaHCO3溶液的浓度可能为 。
用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
(1)光导纤维的主要成分是 ;
(2)目前应用最多的太阳能电池的光电转化材料是 ;
(3)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类具有均匀微孔结构的被称为 (物质类别)的化合物。
(4)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为 ;
(5)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为 ;用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为 。