下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
请回答下列问题:
(1)物质A的化学式为__________。
(2)化合物E的电子式为__________。
(3)反应①的离子方程式为__________;反应②的化学方程式为__________。
X~R是元素周期表中的短周期元素,其相关信息如下表:
| 元素 |
X |
Y |
Z |
W |
R |
| 相关信息 |
能形成+7价的化合物 |
日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
最外层有二个未成对电子,无正价 |
请用化学用语回答下列问题:
(1)基态原子X的核外电子所处最高能层的能层符号是。
(2)Z的氢化物的电子式,中心原子的杂化类型是,元素Z、R的气体氢化物的稳定性顺序是,Z的氢化物易液化,原因是。
(3)R的某种氢化物C有18个电子,工业上利用电解KHSO4水溶液所得的产物与水反应制备C。电解KHSO4水溶液时(该条件下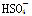 部分电离),阳极反应式是
部分电离),阳极反应式是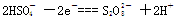 ,阴极反应式是;已知1mol
,阴极反应式是;已知1mol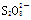 与水反应得到C时转移了2 mol e-,则该反应的离子方程式是。
与水反应得到C时转移了2 mol e-,则该反应的离子方程式是。
(1)请用下列物质的序号填空:①NaF ②C2H4③Na2O2④Ba(OH)2⑤ CO2;只含有极性键的是,既有离子键又有非极性键的是。
(2)C、N、O三种元素的第一电离能由大到小的顺序是。某氧化物MO的电子总数与SiC的相等,则M为(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是。
(3)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
①写出基态Cu2+的核外电子排布式:;在周期表中的位置是。
②如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为。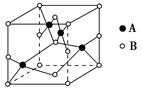
③CuO高温易转化为Cu2O,其原因是。
(10分)甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:
①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。回答:
(1)丁溶液是
(2)乙溶液的电离方程式
(3)丙溶液PH 7, 原因用方程式表示
(4)乙和丁反应的离子方程式
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________
(4)Y的最高价氧化物的水化物与其氢化物反应的离子方程式 。
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该烧杯的实际质量为______________g。
滴定管中的液面如下图所示,正确的读数为mL。
(2)指出下面3个实验中各存在的一个错误: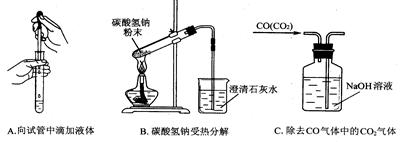
A____________________,B_____________________,C________________________