化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到G,G由碳、氢、氧三种元素组成,相对分子质量为172,元素分析表明,含碳55.8 %,含氢7.0 %,核磁共振氢谱显示只有一个峰。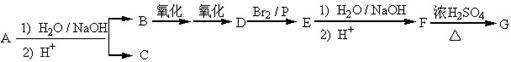
已知: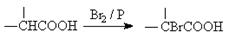
请回答下列问题:
(1)写出G的分子式: 。
(2)写出A的结构简式: 。
(3)写出F→G反应的化学方程式: 。该反应属于 (填反应类型)。
(4)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式:
(仅要求写出1种): 。
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。

 按照实验步骤依次回答下列问题:
按照实验步骤依次回答下列问题:
(1)写出装置中锌电极上的电极反应式:;
(2)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为;
(用“NA”表示)
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧 烧杯移动
烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(4)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. FeD. H2SO4
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图: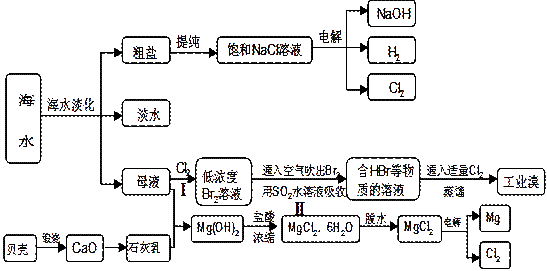
(1)请列举海水淡化的两种方法、。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的是:。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2•6H2O,其原因用化学方程式表示为
(4)上述工艺中可以得到金属M g,请写出工业上冶炼金属铝的化学方程式
g,请写出工业上冶炼金属铝的化学方程式
。
下表是五种银盐的溶度积常数(25℃):
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10- |
6.3×10-50 |
5.4×10-13 |
8.3×10-17 |
下列说法不正确的是:
| A.五种物质在常温下溶解度最大的是Ag2SO4 |
| B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀Ag2S |
| C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大 |
| D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |
在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| B.升高温度,溶液的PH值减小 |
| C.稀释溶液,溶液中c(H+)和c(OH-)都减少 |
| D.加入NaOH固体,溶液pH减小 |
物质的量浓度都为0.1mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.[Na+]+[H+]=[OH-]+[CH3COO-] |
| B.[Na+]>[CH3COO-]>[H+]>[OH-] |
| C.[OH-]=[H+]+[CH3COOH] |
| D.[CH3COOH]+[CH3COO-]=[Na+] |