甲、乙两同学分别都用到铜与硫酸完成下列相关实验,请回答相应的问题.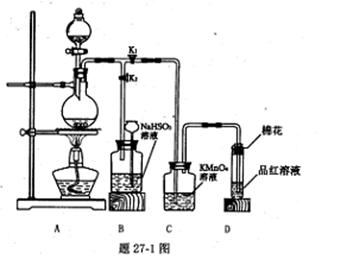
(1)甲同学用题27-1图所示装置实现铜跟浓硫酸反应制取少量硫酸铜溶液,并验证相关物质的性质.
①装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是_____.
②从C、D装置中观察到的现象,说明上述反应的某种生成物所具有的化学性质是 、__ __.
③装置B将用来储存多余气体,当D处有明显的现象后,关闭旋塞K.,打开K2移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_ .
(2)乙同学认为:铜虽不能与稀硫酸直接反应生成硫酸铜,但可以在稀硫酸与铜粉的混合物中分多次加入适量浓硝酸而得到不含NO3—的硫酸铜溶液.其装置如题27-2图所示.
①把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是____
②已知NO不能被NaOH溶液直接吸收:但已知有如下两个反应:

题27-3图是题27-2图的改进装置,其优点除可以防止倒吸外还有___ _
③将反应所得硫酸铜溶液经___ _、 、过滤、洗涤、干燥即可得到胆矾晶体.
④如果用1mol Cu来制取lmol CuSO4,则所需浓硝酸中HNO3的质量为 _,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液吸收并生成NaNO2,需通入空气的体积为____.(假设气体体积为标准状况下测定,空气中氧气占总体积的 ,保留小数点后一位,并忽略装置中原有空气的影响)
,保留小数点后一位,并忽略装置中原有空气的影响)
下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。
(1)调整天平零点时,若指针偏向左边,应将右边的螺丝帽__________(填“向左”或“向右”)旋动。
(2)溶解样品时要用到玻璃棒,其作用是______________________________。
(3)反应生成沉淀的离子方程式为______________________________。
(4)加热蒸发过程中要用到玻璃棒,其作用是______________________________。
(5)过滤中要用到玻璃棒,其作用是______________________________。
(6)洗涤沉淀的目的是__________________________________________________________;
洗涤沉淀的方法是_______________________________________________________________;
为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入__________溶液。
(7)最后一步操作中也要用到玻璃棒,其作用是______________________________。
Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用图1中给出的仪器设计了如图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0 g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。

图1 图2
(1)学生乙认为,按学生甲设计的装置进行实验,存在明显缺陷,其中导致测定结果偏低的是__________。
(2)学生乙对学生甲设计的实验装置进行了完善(如图3)。实验室中可供选择的药品:Zn、浓硫酸、稀硫酸、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题:
图3
①B、D虚框内是否需要添加装置,若需要,在相应虚框内画出装置图(并注明药品);若不需要,在相应虚框内打“×”;
②A装置中分液漏斗内液体为__________;U形管内药品为__________;装置F的作用为__________;
③如果B、D内部不设计任何装置而直接连通ACE,则实验结果将__________(填“偏高”“偏低”或“无影响”);
④如果实验后E装置质量增重3.96 g,则该Na2CO3试样的纯度为__________。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2 g按右图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)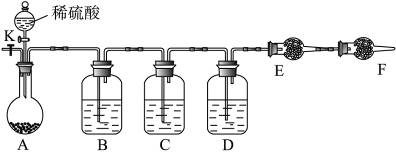
(1)将仪器连接好以后,必须进行的第一步操作是____________________。
(2)此实验还必须用到的最重要的仪器是__________;仪器F的作用是________________________________________。
(3)已知仪器C中装有品红溶液,其作用是______________________________。
(4)实验室中备有以下常用试剂:a.浓硫酸,b.品红溶液,c.酸性高锰酸钾溶液,d.饱和碳酸氢钠溶液,e.氢氧化钠溶液,f.无水硫酸铜,g.碱石灰,h.五氧化二磷。请将下列容器中应盛放的试剂序号填入相应空格:B中__________,D中__________,E中__________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是____________________。所通空气应先经过__________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值__________(填“偏高”“偏低”或“没影响”)。
(5)若仪器E在实验完成时增重4.4 g,则Na2CO3与Na2SO3的物质的量之比为__________。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有__________(填代号,限填3项)。
A.试管
B.瓷坩埚
C.坩埚钳
D.铁三脚架
E.泥三角
F.酒精灯
G.烧杯
H.量筒
(2)第2步:I-溶液的获取。操作是____________________。
(3)第3步:氧化。操作是依次加入合适的试剂,下列氧化剂最好选用__________(填代号)。
A.浓硫酸
B.新制氯水
C.KMnO4溶液
D.H2O2
理由是________________________________________。
(4)碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 |
内容 |
实验现象 |
| 1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
| 2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
| 3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
| 4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
| 5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
| 6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)__________;在电化学腐蚀中,负极反应是__________;正极反应是__________。
(2)由该实验可知,可以影响铁锈蚀速率的因素是____________________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是__________(答出两种方法)。