(本题共8分)
水煤气法制甲醇工艺流程框图如下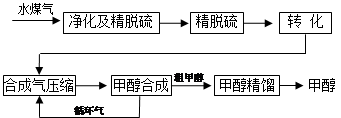
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
②下列能提高碳的平衡转化率的措施是 。
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
某有机物结构简式如下: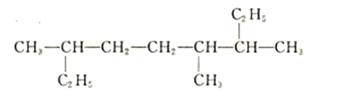
(1)该有机物的分子式为名称为
每个该有机物分子中含个甲基。
(2)、同学们已经学习了几种典型的有机化学反应反应。写出下列反应的化学反应方程式,并判断其反应类型。
①乙烯与溴反应: ,属于反应;
,属于反应;
②由苯制取硝基苯:,属于反应;
③由苯制取环己烷:属于反应
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:。
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行。
(4)所含元素超过18种的周期是第、周期。
(10分)下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,B跟Cl2反应除生成C外 ,另一产物是盐酸盐。
,另一产物是盐酸盐。
用化学式填写下列空格: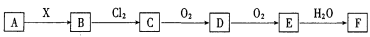
(1)A是__________。
(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是__________。D→E的化学方程式为D通入稀硝酸中反应的离子方程式为
(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是__________。E→F的化学方程式为
(7分)有一无色混合气体可能是由HCl、NO、NO2、CO2、NH3、H2中的一种或几种混合而成,将此气体通过盛有浓H2SO4时的洗气瓶时,气体体积减小。继续通过装有过氧化钠的干燥管,发现从出气口出来的气体显红棕色,再将该气体全部通入盛满水倒立于水槽中的试管内,发现最后试管里仍为一满试管液体.由此可推知原气体中一定存在__________ ____,一定不存在__________ _ ____,由最终结果可知原气体中________ _ 气体的体积比为
根据图示填空
(1)化合物 A 含有的官能团是______________________
(2)1mol A 与2mol H2发生反应生成 1mol E,其反应方程式是__________________________________________
(3)与 A 具有相同官能团的 A 的同分异构体的结构简式是____________________________________________
(4)B 在酸性条件下与 Br2 反应得到 D,D 的结构简式是________________________________________________
(5)F 的结构简式是___________;由 E 生成 F 的反应类型是___________ ___。
___。