X混合气体由H2、CO、CH4的成分组成,为检验气体的成分设计了如下的实验装置(注:夹持装置未画出;无水硫酸铜遇水由白色变成蓝色,可用于检验水的存在):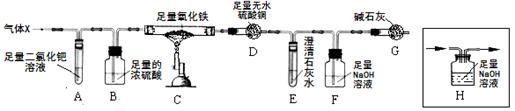
【查阅资料】
(1)CO和二氯化钯(PdCl2)溶液反应产生黑色钯(Pd):CO+PdCl2+H2O=CO2+Pd↓+2X,该反应中X的化学式是 。
(2)在高温条件下,H2可还原氧化铁,产生铁和水。在高温条件下,CH4也可与Fe2O3反应:4Fe2O3+nCH4  8Fe +nCO2+2nH2O,其中n的值为 (填数字)。
8Fe +nCO2+2nH2O,其中n的值为 (填数字)。
【提出假设】关于X混合气体的组成,同学们提出下列假设:
①H2和CO ②H2和CH4 ③CO和CH4 ④H2、CO和CH4
【实验现象】A中出现黑色固体;C中固体逐渐变为黑色;D固体变为蓝色;E中溶液变浑浊。
【问题讨论】
(3)根据以上实验现象,甲同学和老师一致认为:可排除假设 (填假设序号)。
(4)根据以上实验现象,乙认为可排除“假设①”。你认为乙的结论是否正确? 。
(5)丙同学认为:要验证剩余的假设是否成立,需要在A、B之间增加装置H,但该装置未画完整,请在答题卡中将装置画完整。
(6)丁同学利用改进后的装置进行实验,测得实验中装置D质量增加m1g,装置E和F质量增加的总和为m2g,若m1∶m2= (填写比值),则“假设③”成立。
某学习小组在探究酸的化学性质时,做了如右图所示的两个实验: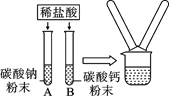
(1)分别向两支装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,两支试管内均观察到的现象是___________,固体粉末全部消失,最终形成无色溶液。
(2)实验结束后,同学们将A、B两支试管中的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊。
小组同学将烧杯中的物质进行了过滤,对滤液中的溶质成分展开了探究,请你一起参与。
【提出猜想】
猜想1:滤液中的溶质是氯化钠;
猜想2:滤液中的溶质是氯化钠和碳酸钠;
猜想3:滤液中的溶质是___________。
【设计实验】请你选择一种猜想进行验证。
【实验探究】
(1)请你依据下图设计一个酸和碱反应的探究实验:
| 实验步骤 |
实验现象 |
结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 |
①溶液颜色 ; ②不断搅拌溶液至溶液颜色变成 色。 |
酸和碱发生了中和反应 |
(2)为探究上述酸、碱反应后硫酸是否过量,甲、乙、丙三位同学设计了以下方案:
| 实验方案 |
实验步骤 |
实验现象 |
实验结论 |
| 甲同学的方案 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
硫酸过量 |
| 乙同学的方案 |
取样,滴入几滴无色酚酞溶液 |
酚酞溶液不变色 |
酸、碱恰好完全反应 |
| 丙同学的方案 |
取样,滴入几滴紫色石蕊溶液 |
溶液变红 |
硫酸过量 |
【实验评价】
①设计的三个方案中,有一个正确的方案,是 (填“甲”、“乙”、“丙”)同学的方案
②请分析另外两个同学方案错误的原因:
一个同学方案错误的原因是 ,
另一个同学方案错误的原因是 。
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑),这种工业成为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究。
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是(用化学方程式表示)猜想二:可能含有NaCl,作出此猜想的依据是(用简洁的文字表述)。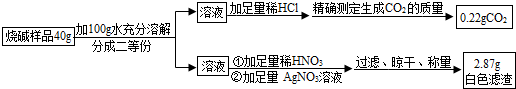 II.定量探究
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程)。
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性。
(2)探究方案中因缺少(填操作名称),导致测得的氢氧化钠的质量分数偏小。
实验室有三瓶没有标签的无色溶液,它们分别是稀硫酸、硫酸钠溶液、碳酸钠溶液。设计一个实验方案,把这三瓶溶液进行鉴别,并完成实验报告。(可供选用的试剂有:酚酞溶液、生锈铁钉、氯化钡溶液)
| 实验步骤 |
预期现象与结论 |
| (1) |
|
| (2) |
小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验。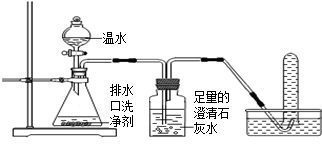
A B C
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是:(填化学式)。B中有关反应的化学方程式是。
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: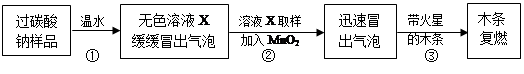
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设: 根据以上实验现象,X溶液中一定存在的溶质是;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl。
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
| 实验操作 |
主要实验现象 |
结论 |
| ① |
证明溶液中有Na2CO3 |
|
| ② |
证明溶液中无NaHCO3 |
|
| ③ |
证明溶液中无NaOH |
(6)实验反思:根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀。于是,同学们猜想:碳酸氢钠与氢氧化钠是否可以发生(写方程式)这样的反应?于是,同学们进行了新的探究实验。