[2012·北京朝阳一模]高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____ ____。
(2)步骤②反应的离子方程式是_____ ___。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为___ _____。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____ _
(答出两点即可)。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。
(4)根据下列数据:
| 滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.20 |
24.10 |
| 第二次 |
20.00 |
3.00 |
27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
某化学兴趣小组为探究SO2的化学性质,设计了如下图所示的装置进行实验。回答下列问题: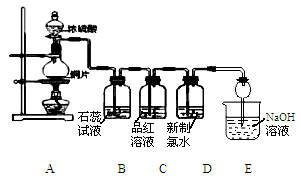
(1)装置A中盛放浓硫酸的仪器名称是________,写出圆底烧瓶发生反应的化学方程式________。
(2)E装置中干燥管的作用是____________________________。
(3)实验过程中,观察到B中的现象是_______________,原因是__________________;观察到C瓶中氯水褪色,这是因为SO2具有_______性,反应的离子方程式为__________________。
(4)用装置C还能探究SO2与品红作用的可逆性,请写出实验操作及现象__________________。
(5)充分反应后,小组同学发现铜和硫酸都有剩余,原因是___________________。若想使剩余的铜溶解,可再加入___________(填序号)。
①盐酸;②硝酸;③NaNO3固体;④K2SO4固体
实验室需要200mL0.2mol∙L-1NaOH溶液。现用NaOH固体配制,可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙;⑧100mL容量瓶;⑨250mL容量瓶。回答下列问题:
(1)上述仪器中,在配制NaOH溶液时必须使用的容器除①、③、⑥、⑦外,还有_________(填数字序号)。
(2)将所配置的NaOH溶液进行测定,发现浓度小于0.2mol∙L-1。请你分析配制过程中可能引起该误差的原因是(填字母序号)_______________。
A.定容时仰视 B.移液时没有洗涤烧杯和玻璃棒 C.配制时容量瓶有少量蒸馏水
(3)将配好的溶液盛装于下列(填字母代号)______________仪器中,贴好标签备用。
A.带玻璃塞的广口瓶 B.带玻璃塞的细口瓶
C.带胶塞的广口瓶 D.带胶塞的细口瓶
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=________,C=___________,E=___________
| 实验编号 |
温度 |
初始pH |
0.1mol/L草酸溶液体积/mL |
0.01mol/LKMnO4 溶液体积/mL |
蒸馏水体积/mL |
待测数据(混合液褪色时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
A |
B |
C |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
D |
E |
t3 |
(2)该反应的离子方程式_____________________________。
(3)若t1<t2,则根据实验①和②得到的结论是________________________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②_________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是:__________;实验中所需的定量仪器有__________(填仪器名称)。该KMnO4溶液的物质的量浓度为________mol/L。
为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序为:装置②→ ;
(2)装置②中主要玻璃仪器的名称 、 、 ;
(3)实验室制备Cl2的离子方程式为____________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入 试纸。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到 的现象,则证明制Cl2时有HCl挥发出来