请你参与下列探究:
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式 。但却对气体的生成产生了疑问,这激发了同学们强烈的探究欲望,生成的是什么气体?
[提出猜想]从物质组成元素的角度,放出的气体可能是O2、SO2、H2。
[查阅资料]SO2易溶于水,它能与过量的NaOH溶液反应,生成Na2SO3。
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则较简单的检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与过量的NaOH溶液反应的化学方程式 。
(3)甲、乙同学实验的结果表明气体中既不含O2也不含SO2。丙同学根据以上实验结果推测气体是H2。
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。
结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有 物质。
(14分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
(14分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.4 mol/L的醋酸溶液,用0.4 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
⑴配制250 mL 0.4 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和_________________。
⑵为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为_____________。(保留小数点后四位)
实验二探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_____________________________________________________________________
_____________________________________________________________________
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度
____________。(填增大、减小或不变)
实验三探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案________________________
______________________________________________________________________。
硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验可能用到的仪器如下图所示:
【提出猜想】
Ⅰ.所得气体的成分可能只含一种;
Ⅱ.所得气体的成分可能含有二种;
Ⅲ.所得气体的成分可能含有三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。请回答下列问题:
(1) 请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
__(填序号)
(2) 若实验结束,B中量筒没有收集到水,则证明猜想正确。
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由。答:
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
| 实验小组 |
称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
| 一 |
6.4 |
2.56 |
298.7 |
| 二 |
6.4 |
2.56 |
448 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_____________;
二组:_。
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是________和_______(填代号)。
某学习小组用如下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。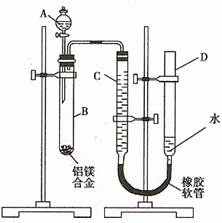
(1)A中试剂为_______________________。
(2)实验前,先将铝镁合金在稀硝酸中浸泡片刻,其目的是_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,
需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是_______________________________(填序号);记录C的液面位置时,除视线平视外,还应_________________________。
(4)B中发生反应的化学方程式为_________________________________________。
(5)若实验用铝镁合金的质量为a g ,测得氢气体积为b mL (已换算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量为____________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________________(填“偏大”、“偏小”、“不受影响”)。
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的试验。回答下列问题:
(1)定性分析:如图甲可通过观察,定性比较得出结论。写出H2O2在二氧化锰作用下发生反应的化学方程式:。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为,实验中需要测量的数据是。检查乙装置气密性的方法是。