(14分)阅读讨论并完成以下各项内容:
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个化学反应的方程式
________________________________________________________________________;
________________________________________________________________________。
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成 ________和NO。
③酸雨可导致的危害有________(填序号)。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮的氧化物用________吸收。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。
①若原料气从左向右流时,上述装置连接的顺序是:原料气→________(用字母和箭头表示)。
②装置②中发生反应的离子方程式为:
________________________________________________________________________;
当装置②中出现________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是________。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选用鉴别的试剂有(填编号)▲(多选题) 。
A.BaCl2溶液B.Ba(NO3)2溶液 C.Ba(OH)2溶液
②鉴别反应的离子方程式:▲。
(2)饱和碳酸钠溶液 、澄清石灰水
、澄清石灰水
①可选用鉴别的试剂有(填编号)▲(多选题) 。
a.盐酸b.硫酸c.硝酸d.BaCl2溶液e.NaCl溶液
②依次写出鉴别中有明显现象的反应的离子方程式:▲。
12.4g Na2R 含有Na+0.4mol,则Na2R的摩尔质量为▲,R的相对原子质量为▲,含R2—1.6g的Na2R的物质的量为▲
下列各组均有四种物质,其中有一种物质与其他三种物质的类别不同,请将该 物质的化学式或名称填在横线上
物质的化学式或名称填在横线上
(1)CuO NO2NaOH Fe2O3_____▲_____________
(2)O2N2Al C______▲____________
(3)糖开水,食盐水,蒸馏水,豆浆______▲____________
(4)H2SO4 NaOH NaCl CO2______▲____________
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒▲
(2)除去NaCl晶体中混有的碘单质▲
(3)分离石油中各不同沸点范围的成分▲
(4)分离水和苯的混合物▲
铜、铁、锌等质量合成的合金W g,加入FeC l3和盐酸的混合液中,充分反应后:
l3和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有,还可能有。
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有,可能还有。一定没有。
(3)若剩余固体为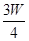 g,则溶液中的阳离子一定有,一定没有.
g,则溶液中的阳离子一定有,一定没有.