某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用下列实验装置制取干燥纯净的氯气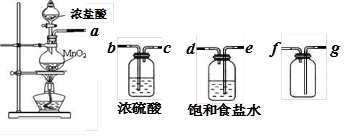
①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为
(填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进?
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②: ;假设③: 。
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 |
实验现象 |
结论 |
| 在溶液中加 KSCN溶液 |
|
固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含______ |
由此得出结论:假设 成立(填序号①②③)。
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
(4)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如右图的装置从得到的废液中提炼金属铜。该过程中甲池负极的电极反应式是 ,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积
(标准状况)为 (假设气体全部逸出)。
实验室需用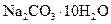 晶体配制500mL0.05mol/L的
晶体配制500mL0.05mol/L的 溶液,请回答下列问题:
溶液,请回答下列问题:
(1)应用托盘天平称取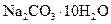 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的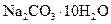 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“ 偏低”、“不变”。):
偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用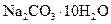 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积 |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度:____________________________
现用98%的浓H2SO4(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
(1)选用的主要仪器有:烧杯、量筒、玻璃棒、、
(2)请将下列操作按正确的顺序把序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.定容,最后用胶头滴管加水至刻度 |
| D.洗涤所用仪器并将洗涤液一并转入容量瓶 |
E.稀释浓H2SO4
F.冷却后将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓H2SO4的体积为mL。
②洗涤烧杯2~3次,洗液没有转入容量瓶,会使最终结果;定容时必须使溶液
凹液面最低处与 刻度相切,若俯视会使结果。(以上填“偏高”、“偏低”或“无
刻度相切,若俯视会使结果。(以上填“偏高”、“偏低”或“无
影响”)
下列说法中,正确的是____
| A.选用酒精作为萃取剂从碘水中萃取碘 |
| B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C.在做蒸馏实验时,冷凝器中的水流方向应该与馏分的流动方向相反 |
| D.蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热 |
E.分液漏斗使用前不需要检查是否漏水,但需要用蒸馏水润洗2~3次
F.浓硫酸不慎沾在皮肤上,立即用稀氢氧化钠溶液冲洗
G.蒸馏操作时,应使温度计水银球插入蒸馏烧瓶中液面下,但不能接触瓶底
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.过滤 |
(1)分离饱和食盐水与沙子的混合物。______
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾。______
(3)分离水和汽油的混合物。___ ___
___
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。______