甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/MPa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为 。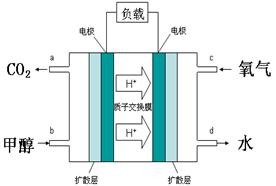
(10分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,
①它们的分子式分别是________、________;
②杂化轨道分别是________、________;
③a分子的立体结构是________;
(2)X的氧化物与Y的氧化物中,分子极性较小的是________;(填分子式)
(3)Y与Z比较,电负性较大的是________;(填元素名称)
(4)W的元素符号是________,其+2价离子的核外电子排布式是________。
向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN==Fe(SCN)3+3KCl表示。
(1)该反应类型属于。(填四个基本反应类型之一)
(2)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该配合物离子的化学式是,FeCl3溶液与KSCN溶液发生反应的产物中含该离子的配合物化学式是。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为。
(3)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于(单选)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是____________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g),若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K= (K为A与n的比值)。请用编号回答下列问题:
(K为A与n的比值)。请用编号回答下列问题:
A.两性 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____性越强
(2)当A一定时,K值越小,则元素的_____性越强
(3)当K=0,则该元素系_____元素,当K=l时(n≠1),则该元素系_____元素,当K<1时,该元素系____元素
下表为元素周期表的一部分,请参照元素A-K在表中的位置,
| 族 周期 |
IA |
0 |
||||||
| 1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
B |
C |
D |
|||||
| 3 |
E |
F |
G |
K |
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。