(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O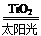 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O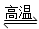 CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列说法正确的是_____。
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(8分)有人设想合成具有以下结构的烃分子.
(1)结构D显然是不可能合成的,原因是 ▲.
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,金刚烷的分子式为 ▲
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是 ▲
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃的同分异构体是生产某塑 料的单体,写出合成该塑料的化学方式 ▲
料的单体,写出合成该塑料的化学方式 ▲
(9分)根据要求填空:
(1)写出下列有机物的键线式: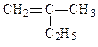 _____▲ ______CH3CH2CH2COOH __▲ _______
_____▲ ______CH3CH2CH2COOH __▲ _______
(2)写出有机物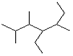 的名称 ▲
的名称 ▲
(3)写出下列原子团的电子式:①甲基 ▲②氢氧根离子 ▲
(4)在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”。C7H16的同分异构体中具有“手性碳原子”的有___▲ ____种.
(5)某有机高分子化合物的结构片段如下: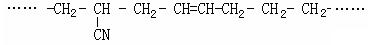
则合成它的单体是▲、▲、▲
为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1) 过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠有发生了还原反应的是
| A.MnO2 | B.KMnO4溶液 | C.Na2SO3溶液 | D.稀硫酸 |
(2) 漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。当生成1m olClO2时转移的电子数是
olClO2时转移的电子数是
(3) 二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为
(1)某化学反应可用下式表示:A + B ="=" C + D + H2O ,若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式:
(2)硝酸铅的稀溶液中,滴入几滴稀 生成白色
生成白色 沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式①②
沉淀,再滴入数滴饱和NaAc溶液,微热,并不断搅动,沉淀慢慢溶解,以上发生的都是复分解反应,写出反应过程的离子方程式①②
(3)边微热边向铵明矾[NH4Al(SO4)2`12H2O]溶液中逐滴加入 溶液至中性(提示:NH+ 4、Al3+恰好完全反应)
溶液至中性(提示:NH+ 4、Al3+恰好完全反应)
①此时发生反应的离子方程式为
②向以上所得中性溶液中继续滴加稀硫酸,相关反应的离子方程式是:
⑴写出下列物质的电离方程式:
①CuCl2②Na HCO3
HCO3
③KHSO4
⑵按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②硫酸镁溶液中滴加氢氧化钡溶液
⑶写出与离子反应方程式CO2+2OH-=CO32-+H2O所对应的其中一个化学方程式