覃昉在完成了对蜡烛生成物的探究后,她继续探究了天然气(主要成分甲烷—CH4)燃烧后的生成物是否有水和二氧化碳生成的实验。
(1)请你帮她完成下表:
| 猜想 |
实验步骤 |
实验现象 |
实验结论 |
| 天然气燃烧后有水生成 |
点燃天然气, ,并观察现象。 |
|
天然气燃烧后生成物中有水 |
| 天然气燃烧后有二氧化碳 生成 |
点燃天然气, ,并观察现象。 |
|
|
(2)在此探究实验中你还可以得出的结论有 。
市场上的薯片、虾条等食品一般采用充气包装,它使用的是什么气体呢?小明和小红对市场上销售的一种虾条发生了兴趣,因为虾条包装在充满气体的小塑料袋内,袋内的气体冲得鼓鼓的。他们认为这种充气包装技术,主要是为了使食品能够较长时间的保鲜、保质。那么,这是什么气体呢?
小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤:,
(2)小明的猜想如果正确,现象应是。
(3)你认为食品充气包装,对所充气体的要求是:(写一点)。
化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭” 。他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3。
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CuCl2溶液发生复分解反应。
③Na2O是白色固体,与H2O反应生成NaOH。
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)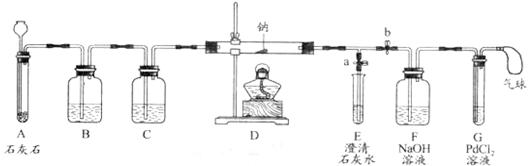
(1)实验记录
| 序号 |
实验操作 |
主要实验现象 |
实验结论和解释 |
| ① |
打开a,关闭b,由长颈漏斗注入稀盐酸 |
A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为_____________ |
| ② |
当E中出现浑浊时,打开b,关闭a,点燃酒精灯 |
D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 |
反应产物一定有_______和_______ |
| ③ |
取D中白色固体于试管中,加水溶解,再加入石灰水 |
产生白色沉淀 |
反应产物还有________ |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是___________。
②若无装置C,对实验有影响的物质是__________。
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,
。
下列两组装置图都与我们学过的气体的制取和性质有关。
(1)根据下图(A~E)所给的装置,回答下列问题:
实验室用高锰酸钾制取和收集氧气,可选用的装置为(填字母),反应方程式为;实验室用过氧化氢制取和收集氧气,可选用的装置为(填字母),反应方程式为;实验室制取和收集二氧化碳,可选用的装置为(填字母),反应方程式为。
(2)在实验室中,集气瓶被称做“万能瓶”,用它可以组装成各种用途的装置,请仔细观察下列(F~K)各个装置的特点回答下列问题: 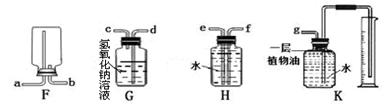
①实验室若用F装置收集氧气,则氧气应从口进入(填导管口的字母代号)。
②若要收集一定体积的二氧化碳气体,应选用装置。
③若要除去一氧化碳中的少量二氧化碳,同时用该瓶收集较纯净的一氧化碳,应选用装置。
黄铜(铜、锌合金)呈金黄色,外观似黄金,一些不法分子用黄铜冒充真黄金进行诈骗活动,请你用所学化学知识如何鉴别真假黄金?(写出三种方案)(写出实验步骤、现象、结论)
四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH
【查阅资料】①Na2S4受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
②硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
③NaOH溶液可吸收硫化氢和二氧化碳。
【实验过程】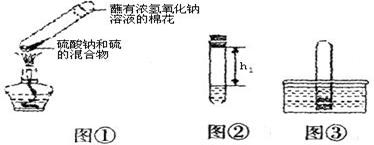
①取0.5g碳酸钠、0.2g硫粉混合后置于试管中,加入(如图①所示,夹持装置已略去),制得Na2S4,反应为:4Na2CO3+12S+X 2Na2S4+2Na2S2O3+4CO2,X的化学式为;
2Na2S4+2Na2S2O3+4CO2,X的化学式为;
②冷却后,取下棉花,放置一段时间,再向该试管中加入10mL水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图②所示);
③将该试管插入水中(如图③所示),拔下橡胶塞,观察到,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离h2,记录数据h2。理论上h2:h1=;
④按照①~③再重复实验2次。3次实验数据如下表所示。
| 第1次 |
第2次 |
第3次 |
|
| h1/cm |
11.0 |
11.4 |
11.6 |
| h2/cm |
8.7 |
9.1 |
9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为%(结果精确到0.1%);
【反思与评价】实验过程①中浓NaOH溶液的作用是;若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,测定结果(填“偏大”、“偏小”或“无影响”),理由是:。