氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________;
(2)估算该离子反应的平衡常数__________
(3)在上述平衡体系中加入少量NaOH固体,平衡将向____反应方向移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向_____反应方向移动。
(5)下列事实不能用勒夏特列原理解释的是
| A.实验室将氨水放在低温处密封保存 |
B.对于2HI(g) H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。 H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。 |
| C.在实验室可用排饱和食盐水的方法收集氯气。 |
| D.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。 |
五种元素A、B、C、D、E位于元素周期表的前四周期,已知它们的核电荷数依次增加,A是宇宙中含量最多的元素;B原子的L层p轨道中有2个电子;C与B原子的价层电子数相同;D原子M层的d轨道有一个成对电子;E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1。
(1)B与A形成只含一个中心原子的共价化合物,其分子的结构式为;
(2)B与C比较,电负性较大的(填元素名称)____________;
(3)写出D的外围电子排布式;
(4)E与Al的化学性质相似,请写出E与NaOH溶液反应的化学方程式。
以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的 是
是 ;
;
(2)既含有极性键又含有非极性键的是;
(3)既有σ键又有π键的是; (4)含有s—sσ键的是
(4)含有s—sσ键的是 ;
;
(5)以上物质为固体时,属于离子晶体的是。
中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与B反应的离子方程式为________________。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为__________________。
(3)若该反应是实验室制取C气体的反应。已知C是无色刺激性气味的气体,其水溶液呈弱碱性,C能生催化氧化反应。写出该反应的化学方程式________________。
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述反应的化学方程式________________________。
(6分)⑴在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是,只含有极性键的是,既含离子键又含非极性共价键的是 。
(2)写出下列物质的电子式:
CO2 NaCl HClO
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: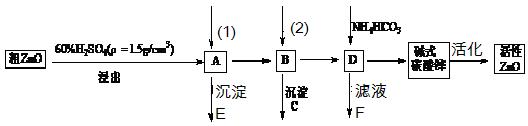
已知此溶液中Fe2+、 Fe3+、 Cu2+、 Zn2+形成氢氧化物的pH如下表
| 离子 |
开始沉沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.5 |
| Zn2+ |
6.8 |
9 |
(1)已知H2O2酸性溶液中能氧化Fe2+,反应的离子方程式为
(2)题目中框图中的(1)和(2)是需要加入的试剂依次是_______、_______。(用序号回答)
①ZnO②H2O2较浓溶液③Na2CO3溶液
(3)加入试剂(2)应将杂质离子完全转化成沉淀C, 溶液的pH应控制在;
要实现该步骤中pH的控制,应使用来检查溶液的pH
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式.
(5)重晶石(主要成分BaSO4)是制备钡的化合物的重要原料,但BaSO4不溶于酸,工业上常常将其转化为BaCO3,再进一步制备其他钡的化合物。已知Ksp(BaSO4) = 1.0×10-10,Ksp(BaCO3) = 2×10-9。计算将BaSO4(s)转化为BaCO3(s)所需C(CO32-)应mol/L