现有失去标签的两瓶无色溶液:氢氧化钠溶液和稀盐酸。某化学探究小组打算用化学方法加以区别。请回答:
在不选用酸碱指示剂、pH试纸的情况下,按表中方法一(示例)填写。所选试剂须属于不同物质类别(单质、氧化物、酸、碱、盐、有机物等)。
| |
所选试剂 |
判别方法 |
| 方法一 |
锌 |
取少量样品分别与锌反应,有气体产生的是稀盐酸,没有的是氢氧化钠溶液。 |
| 方法二 |
|
|
| 方法三 |
|
|
我会实验
根据图完成下列各题。( 共18分,每空2分)
A BC D E
郭大志同学欲探究氧气的性质,他用过氧化氢为原料制取并收集几瓶氧气。请回答下列问题
(1).实验室用过氧化氢制取氧气可选用和装置连接制取和收集氧气。
(2).郭大志同学收集了一瓶氧气用来做铁丝燃烧的实验,结果看不到火星四射的现象,其原因可能的是(任写一点)。经过排查,实验成功了,请写出铁丝燃烧的化学反应表达式(用化学式或文字表示均可),
(3).A装置漏斗下端管口插到液面下,是为了防止。C、E装置中的导管末端均接近集气瓶底部,其目的是。
(4).实验室用加热固体醋酸钠和碱石灰粉末的方法制备甲烷气体(密度比空气小,难溶于水),可选用和装置连接制取和收集甲烷。张光标同学在制取甲烷气体的过程中,发现试管破裂了,其原因可能是(写一点)
我会探究 ( 共10分,每空2分)
请你参与下面的实验探究,把下列表格和横线的空白处填写完整。
(1)提出问题:陈胜同学用“双氧水”(过氧化氢)清洗伤口时,不小心将过氧化氢溶液滴到水泥地板上,发现有大量的气泡产生。陈胜联想到自己曾用二氧化锰做过氧化氢的催化剂。他想,水泥块是否也可以做过氧化氢分解的催化剂呢?于是他到附近的建筑工地取回一些水泥块,并用蒸馏水浸泡、冲洗、干燥,并进行了以下的实验探究。
(2)猜想:水泥块能做过氧化氢的催化剂。
(3)实验验证:
| 实验步骤 |
实验现象 |
实验结论 |
|
| 实验一 |
木条不复燃 |
常温下过氧化氢溶液不分解 |
|
| 实验二 |
在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 |
木条复燃 |
(4)结论:水泥块能加快过氧化氢的分解速率,故水泥块能做过氧化氢分解的催化剂。
(5)讨论与反思:张山认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验,探究。
该实验步骤如下:
A、准确称量水泥块的质量;B、完成实验二;C、待反应结束后,将实验二试管的物质进行过滤 、洗涤 、干燥、。D、对比反应前后水泥块的质量。
分析:如果水泥块反应前后质量不变,则说明水泥块可以做过氧化氢分解的催化剂。
(6)李朋认为,要证明陈胜的猜想,张山的补充实验还不够,还需要再补充一个探究实验,探究。
在学校的国庆联欢会上,某同学表演了“水能生火”的魔术。他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。小军对此很感兴趣,于是,进行探究。
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想] ① 可能有一种气体和另一种物质生成
② 反应过程中可能有能量变化
[设计装置]如图所示
[实验探究]
实验一:探究反应后生成的气体是什么?
⑴ 打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是。
⑵ 实验中,还观察到伸入烧杯中的导管口有气泡冒出,
请解释产生该现象的原因:;
实验二:继续探究反应后生成的另一种物质是什么?
⑴ 小张猜想另一种物质是Na2CO3,小军认为不可能。
小军的依据是:;
为了证实小军的看法,请你帮助设计一个证明Na2CO3不存在的实验。从资料中查阅知道:Na2CO3与稀盐酸反应会产生二氧化碳。
| 实验步骤 |
实验现象 |
实验结论 |
| 向反应后试管中的剩余物加适量的稀盐酸,并将可能产生的 气体通入澄清石灰水中 |
若__________________ 实验中无此现象 |
说明__________________ 说明__________________ |
⑵ 小军从资料中查阅知道:若向含有OH—的溶液中滴入无色酚酞试液,就会出现红色。于是他取反应后所得的溶液于试管中,滴入无色酚酞试液,发现酚酞试液变红色,说明反应后所得的剩余物中含有(写物质名称或化学式)。
[表达]由实验探究的结果,写出过氧化钠和水反应的化学方程式:。
通过一年的化学学习,相信你已经初步掌握了实验室制取气体的有关知识。请结合图示回答问题。
(1)写出图中标示的仪器名称:①,②。
(2)实验室用KMnO4制取O2,应选用的发生装置为(填字母序号,下同),收集装置可选用(写一种即可),取用KMnO4药品时,应选用仪器,写出该反应的化学方程式。
(3)注射器C可用于检查装置E的气密性,步骤如下:
①向锥形瓶中加入少量水至处。
②将注射器C连接到装置E的导管口处。
③缓慢拉动注射器C的活塞,观察到,表示装置E的气密性良好。
(4)实验室用装置E制取CO2时,如用注射器C替换长颈漏斗,优点是。
(5)通过查阅资料得知:氨气(NH3)在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是。(填字母编号)请写出氨气和氧化铜反应的化学方程式。
一同学用某种粗盐进行提纯实验,步骤见下图。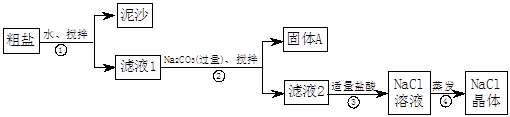
请回答:
(1)步骤①和②的操作名称是。
(2)步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻棒不断搅拌,这是为了防止,当蒸发皿中有较多量固体出现时,应,用余热使水份蒸干。
(3)猜想和验证:
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
猜想Ⅰ成立 |
|
| 猜想Ⅱ:固体A中含BaCO3 |
取少量固体A于试管中,先滴入,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
|
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水, |
猜想Ⅲ成立 |