一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: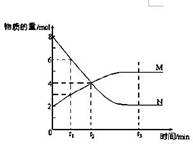
(1)该反应的化学方程式是_____________ ______。
(2)在图上所示的三个时刻中, (填t1、t2或t3)时刻处于平衡状态,此时V正 V逆(填>、<或=);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(3)若反应容器的容积不变,则压强不再改变 (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率
| A.升高温度 | B.降低压强 | C.减小M的浓度 | D.将反应容器体积缩小 |
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操作 |
现象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH |
pH试纸变红(约为4) |
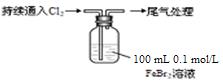 |
ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是。
(2)pH≈4的原因是(用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:① Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;② Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是;证明原因②的实验方案是。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
| 试管 |
操作 |
现象 |
结论 |
| a |
取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
Cl2的氧化性强于Fe3+ |
|
| b |
取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 |
CCl4层没有明显变化 |
|
| c |
CCl4层由无色变为橙黄色 |
Cl2的氧化性强于Br2 |
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:(1)稀硝酸和Cu反应的化学方程式为。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①据实验现象写出发生反应的离子方程式:。
②导致实验过程中溶液pH略有上升的可能原因是。
③解释乙同学的实验现象。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:。
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为,反应中消耗1mol的MnO4—时转移电子数为。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是,又变为棕黄色的原因是。
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。



试回答:
(1)B装置中Cu电极上的电极反应式为,D装置中Fe电极上的电极反应式为。
(2)D装置中的实验现象有,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是(填B或C)。
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL)(标况下) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,你认为原因是。
(2)4~5 min时间段的反应速率最小,你认为原因是。
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2OB.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末
你认为可行的是(填编号)。