已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8kJ/mol
试计算下述反应的反应热2C(s)+O2(g)+2 H2(g)=CH3COOH(l)
化学反应原理在工业生产中具有十分重要的意义。
(1)合成氨用的氢气有多种制取方法:请你写出用C制备水煤气的化学反应方程式。还可以由天然气或重油制取氢气:CH4+H2O(g) 高温催化剂CO+3H2;比较以上两种方法转移6mol电子时,C和CH4的质量之比是。
(2)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下: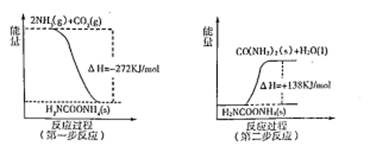
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为。
(3)已知反应Fe(s)+CO2(g)=FeO(s)+CO(g)△H=akJ/mol。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K=,a0(填“>”、“<”或“:”)。在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5min后达到平街时CO2的转化率为,生成CO的平均速率v(CO)为。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g)△H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g)△H=-52.7 kJ·mol-1
N2O4(g)△H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
测得平衡时数据如下:
| 平衡时物质的量(mol) |
n(NO) |
n(H2O) |
| 温度T1 |
1.6 |
2.4 |
| 温度T2 |
1.2 |
1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率
v(NH3)=。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为: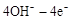 =O2↑+2H2O,则阴极反应为。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由。
=O2↑+2H2O,则阴极反应为。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由。
(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。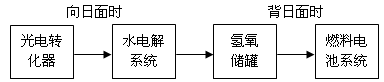
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为mol。
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图6所示。请回答下列问题
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·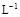 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·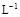 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+= +5Fe3+ +2H2O
+5Fe3+ +2H2O
14H+ + +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
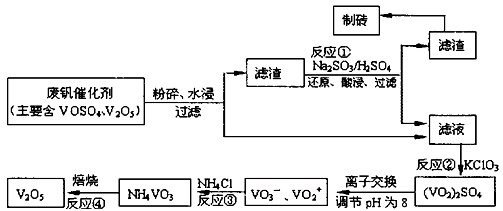
该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为。
(2)反应①的目的是。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g) 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。
①该条件下反应2SO2(g)+O2(g) 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;
②下列措施能使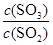 增大的是_____。
增大的是_____。
A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
(1)某学习小组利用下图装置制取氯气并探究其性质。
①甲装置中反应的化学方程式是;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象);
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 |
预期现象和结论 |
|
| ① |
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 |
若无气体放出且澄清石灰水未见浑浊,则假设一成立; |
| ② |