某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。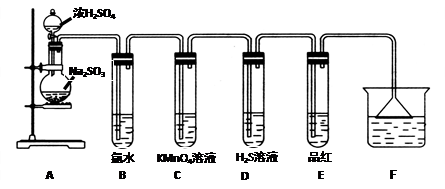
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是 、 ;
(2)反应后,装置B中发生的现象是 ,反应的离子方程式为 ;装置C中的现象是 ,表现了SO2的 ;装置D中现象是 ,发生反应的化学方程式为 ;
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 。
(4)F装置的作用是 ,漏斗的作用是 。
Na2O2与水的反应实际是Na2O2 +2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:
①称取过氧化钠固体2.00g
②把这些过氧化钠固体放入气密性良好的气体发生装置中
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平
④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切
⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为______的量筒
(2)该实验应选用______(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,若此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是 。
(4)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是 。
(5)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)。
汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成。某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质。
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
写出一氧化碳与一氧化氮反应的化学方程式:
II.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答: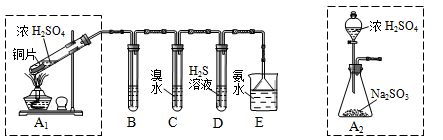
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;C中反应的离子方程式为 。
(2)为了实现绿色环保的目标,制取SO2装置最好选择 。(A1或A2装置)
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。 现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 步骤3: |
|
(14分)实验室有一瓶碳酸钠试剂,含少量Na2SO4杂质.某学生设计如下实验来确定其纯度.
(1)有以下实验操作步骤,其正确的操作顺序是____________.
| A.称取样品W1 g |
| B.加盐酸酸化 |
| C.用蒸馏水溶解 |
| D.过滤 |
E.加入过量的氯化钡溶液
F.洗涤
G.干燥
H.称量沉淀质量为W2 g
(2)酸化时盐酸是否需过量,其原因是_____________。
(3)BaCl2溶液要过量的目的是__________________。
检验BaCl2已过量的方法是_________。
(4)洗涤的目的是______________,检验沉淀已洗干净的方法是__________。
(5)样品中Na2CO3的纯度为____________。
(10分)掌握仪器的名称,组装及使用方法是中学化学实验的基础,如图为两套实验装置。
(1)写出下列仪器的名称:
① ② ④ ;
(2)仪器①~④中,使用时必须检查是否漏水的是:(填序号) 。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;该实验操作过程中需要通入冷却水,通入的方向是 (g或f)口进水, (g或f)口出水。
(4)现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。
某兴趣小组拟制备氯气并验证其一系列性质。
Ⅰ.【查阅资料】
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色。
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂。
Ⅱ.【性质验证】实验装置如图所示(省略夹持装置)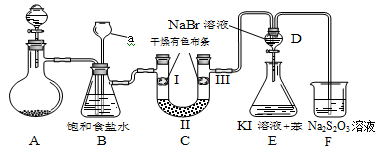
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是 ;装置CⅡ处加的试剂可以是 (选填下列字母编号)。
A.碱石灰 B.硅胶 C.浓硫酸 D.无水氯化钙
(2)装置B的作用有 。
(3)写出装置F中相应的离子反应方程式: 。
Ⅲ.【探究与反思】
上图中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为下图所示装置进行实验。实验操作步骤如下: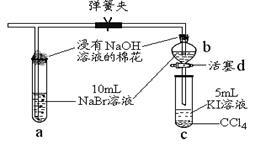
①打开弹簧夹,缓缓通入氯气
②当a和b中的溶液都变为黄色时,夹紧弹簧夹。
③当a中溶液由黄色变为棕色时,停止通氯气。
④ 。
(4)设计步骤③的实验目的是 。
(5)步骤④的操作是 。