军事上的“地表伪装”是使军事保护的外观色彩、红外反射与环境吻合。BASF是在20世纪70年代开发的苝系新型红外伪装还原染料,该染料为橄榄色或黑色。其化学结构为: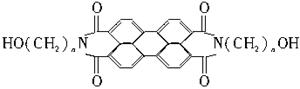
请完成下列问题:
(1)染料BASF的分子式可表示为C2n+24HxN2O6,则x=_________。
(2)1 mol该物质与Na反应产生氢气的量及在催化剂作用下加成所需氢气的量,其最大值(物质的量)分别为_________、_________。
(3)当n=3时,其中碳原子上的一氯取代物可能有_________种。
下列物质中,物质的量最大的是________,含分子个数最多的是________,含原子个数最多的是________,质量最大的是________。
| A.6 g H2; | B.0.5 mol CO2; | C.1.20×1024个HCl分子; | D.148 g H2SO4; E.92 g乙醇(C2H5OH); F.4 ℃时10 mL水 |
( 10分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
(1)在地壳深处容易有气体逸出,在地壳浅处容易有沉积。
(2)如果上述反应的平衡常数K值变大,该反应(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为。
(1)氯化铝水溶液呈性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示):。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式)。实验室在保存AlCl3溶液时,常在溶液中加少量的,以(填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈性(填“酸性”,“中性”或“碱性”),溶液中c(Na+)c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+)c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈性,(填“酸性”,“中性”或“碱性”),醋酸体积氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-)c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因(用离子浓度关系式表示)。
⑴下列物质属于非电解质的是,属于弱电解质的是(填序号)。
①氨水 ②SO2 ③CI2 ④次氯酸 ⑤BaSO4⑥乙醇 ⑦H2O ⑧NaHCO3
⑵用浓度为0.1 mol·L-1标准盐酸滴定氢氧化钠溶液时,以下操作会使结果偏低的是
(填序号)。
①锥形瓶用待测液润洗 ②酸式滴定管读数是滴前仰视滴后俯视
③配制氢氧化钠溶液时混有碳酸钠 ④酸式滴定管未用标准液润洗
(3) 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,写出反应的离子方程式:;此时溶液呈性(填“酸性”,“中性”或“碱性”),原因:。
在火箭推进器中装有还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知一些键断裂所需能量数据:
N-N:159 kJ /mol N="N:419" kJ /mol N≡N:945 kJ /mol H-H:436 kJ /mol
N-H:389 kJ /mol H-O:465 kJ /mol O-O:138 kJ /mol O="O:498" kJ /mol
①写出肼和过氧化氢的结构式:肼_________,过氧化氢______
②写出肼和双氧水反应的热化学方程式_____________________________。