可以由下列反应合成三聚氰胺:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______________________________________________________________________。
CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和________(填化学式),由此可以推知CN的空间构型为________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________________。
(3)三聚氰胺  俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 后,
后,
三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________。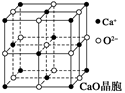
已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离 ________________ __(列出计算式)
CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是______________ ______。
电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。上述元素中,原子半径最小的是(用元素符号表示),与硫同周期的元素中简单离子半径最小的是(用离子符号表示);
(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。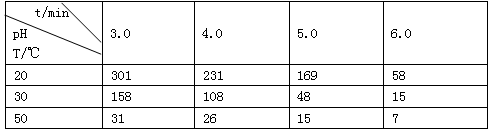
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)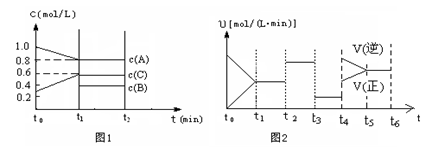
①你认为t3时改变的条件是(填写“加压”或“减压”),B的起始物质的量为mol;
②各阶段平衡时对应的平衡常数如下表所示:
| 时间段 |
t1~t2 |
t2~t3 |
t3~t4 |
t5~t6 |
| 平衡常数 |
K1 |
K2 |
K3 |
K4 |
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系 写此条件下该反应的热化学方程式 ________________
(3)工业上一般采用CO(g) + 2H2(g)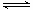 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为,此时的温度250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是: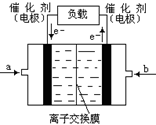
(1)把a、b、c、d 四块金属片浸入稀H2SO4中,分别用导线两两相连可以组成原电池。a、b相连时,导线上电子由 a→b;c、d相连时,电流由 d→c; a、 c相连时 c极上产生大量气泡; b、 d相连时,d极发生氧化反应。这4种金属的活动性由强到弱的顺序是_______________
(2)王同学想在钥匙上镀上一层铜,设计电解实验时,钥匙应和电源的极相连。
(3)碳作阳极,铜作阴极电解MgCl2溶液的离子方程式:
碳作阴极,铜作阳极电解硫酸钠溶液的化学方程式:
(4)用惰性电极电解饱和食盐水,当电源供给0.2mol电子时,停止通电。若此时溶液体积为2L,则所得电解液的pH是。(不考虑气体的溶解)
(5)将含有0.4mol Cu(NO3)2和0.4mol KCl的溶液1 L,用铂电极电解一段时间后,在一个极析出0.3mol红色物质,则另一个极上放出气体(标准状况下)为L。
(1)已知:25℃时,一些弱电解质的电离常数如下:NH3·H2O:1.77×10—5 H2CO3:4.3×10—7(第一步电离)。则:NH4HCO3溶液显性 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈性,醋酸体积(填“>”、“<”、“=”)氢氧化钠溶液体积。
(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,A溶液呈碱性的原因是(用离子方式程式表示)________________
(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是:;有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请您运用所学知识解释
(5)已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15。在AB2、AC均为饱和的混合液中,测得c(B—)=1.6×10—3 mol·L-1,则溶液中c(C2—)为mol/L。
如图,X和Y均为石墨电极:
(Ⅰ)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为_____________;电解过程中____极(填“阴”或“阳”)附近会出现红色;
(Ⅱ)若电解液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。
(1)电解后溶液的pH为___;要使电解后溶液恢复到电解前的状态,需加入一定量的____(填加入物质的化学式)。(假设电解前后溶液的体积不变)
(2)请你推测原溶液中所含的酸根离子可能是____;并设计实验验证你的推测,写出实验的操作步骤、现象和结论: