实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.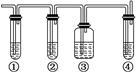
完成下列问题:
(1)图中①、②、③、④装置可盛放的试剂是:
①________;②________;③________;④________.
(将下列有关试剂的序号填入上述空格内)
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明二氧化硫气体存在的现象是__________________________________.
(3)使用装置②的目的是_____________________________________________.
(4)使用装置③的目的是_______________________________________________.
(5)确认含有乙烯的现象是_____________________________________________.
请按下列要求填空
(1)支链上只有一个乙基,且式量最小的烷烃的名称。
(2)将甘氨酸(H2N-CH2-COOH)和丙氨酸( )缩合最多可形成____种二肽。
)缩合最多可形成____种二肽。
(3)有机物X的键线式(如右图所示)。
另一有机物Y是X的同分异构体,且属于芳香烃,请写出Y与乙烯在一定条件下发生聚合反应的化学方程式:。
某有机物 A结构如右图所示,取Na、NaOH、H2在一定条件下分别与等物质的量的A充分反应,理论上需要上述三种物质的物质的量之比为__________。
A结构如右图所示,取Na、NaOH、H2在一定条件下分别与等物质的量的A充分反应,理论上需要上述三种物质的物质的量之比为__________。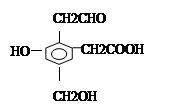
工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g)  2NH3(g)ΔH=-92.4kJ·mol-1。请回答:
2NH3(g)ΔH=-92.4kJ·mol-1。请回答:
(1) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、 H2和NH3的量),反应速率与时间的关系如右图所示。
H2和NH3的量),反应速率与时间的关系如右图所示。
图中t1时引起平衡移动的条件可能是 __,t3时引起平衡移动的条件可能是 __ ___, 其中表示平衡混合物中NH3的含量最高的一段时间是。
(2) 温度为T ℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的值为 ___________________。请在答题卷上写出具体的计算过程。
(7分) 通过实验测定反应速率的方法有多种,如比较锌粒与不同浓度硫酸反应时的速率,可通过测定___________________来实现;在KMnO4与H2C2O4反应中,可通过测定_______________________来测定该反应的速率。请写出H2C2O4与H2SO4酸化的KMnO4反应的化学方程式________________________________________ _________________。
_________________。
(10分)甲 醛是一种重要的化工产品,可利用甲醇催化脱氢制备。气态甲醛与气态甲醇转化的能量关系如图所示。
醛是一种重要的化工产品,可利用甲醇催化脱氢制备。气态甲醛与气态甲醇转化的能量关系如图所示。
(1) 甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
(2) 过程Ⅰ与过程Ⅱ的反应热是否相同?_________,原因是_______________________。
(3) 写出甲醇催化脱氢转化为甲醛的热化学反应方程式___________________________。
有A、B、C、D四种单质。在一定条件下,B可以和A、C、D化合生成化合物甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙每个分子中都含有10个电子,并且甲、乙、丙、丁有如下关系: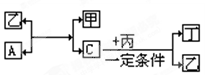
回答:
(1)单质B的化学式。
(2)单质A与化合物乙反应的化学方程式。
(3)根据化合物丙、丁中D 元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。
元素化合价判断丙、丁是否在一定条件下生成单质D,简述判断理由。