元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|
|
|
|
|
|
⑩ |
| 2 |
|
|
|
|
⑥ |
|
⑦ |
|
| 3 |
② |
③ |
④ |
|
|
|
⑧ |
|
| 4 |
⑤ |
|
|
|
|
|
⑨ |
|
请回答下列问题:
(1)十种元素中化学性质最不活泼的是 (填元素符号);
(2) 在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式);
(3) 元素①、②、⑤按原子半径由大到小的顺序依次为 (填元素符号),
原因 ;
(4) 元素⑥的氢化物的化学式为 ,其水溶液呈_____性(填“酸”、“碱”或“中”);
(5) 灼烧元素②与元素⑧形成的化合物,火焰呈 色;
(6)十种元素中 (填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为 。
金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是(填化学式,下同);适宜做耐火材料的是。
(2)若Na2CO3粉末中混有少量NaHCO3杂质,最适宜的除杂方法是,反应的化学方程式为。
(3)要除去铁粉中混有的少量铝粉,适宜的试剂是,发生反应的离子方程式为。
(4)取少量FeCl2溶液,按下图所示操作,使其跟NaOH溶液反应。可观察到的实验现象是。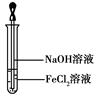
(5)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是(填序号)。
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
A、B、C、D、E、F、G、H、I均是中学化学中常见的气体,它们均由前18号元素组成,具有如下性质:
①A、E、F、G能使湿润的蓝色石蕊试纸变红,B能使湿润的蓝色石蕊试纸先变红后褪色,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白;
③B和E都能使品红溶液褪色;
④将红热的铁丝伸入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条伸入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后在强光照射下产生A。
回答下列问题:
(1)④中发生反应的化学方程式是。
(2)⑤中发生反应的化学方程式是。
(3)C的化学式是,D的化学式是。
(4)写出实验室制I的化学反应方程式。
(1)0.6 mol NH3分子中所含氢原子数与________mol H2O分子中所含氢原子数相等。
(2)2.3 g Na跟足量水反应,失去电子的物质的量为________mol。
(3)现有以下物质:①NaCl晶体②干冰③稀醋酸溶液④汞⑤蔗糖(C12H22O11)⑥冰醋酸(纯净的醋酸CH3COOH);请回答下列问题(用序号):
以上物质中能导电的是;以上物质中属于电解质的是。
(12分) 向某密闭容器中加入0.3mol A、0.08mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示[t0~t1阶段的c(B)变化未画出]。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t4~t5阶段为增大容器体积(即减压)。
(1)写出该反应的化学方程式:。
(2)若t1 = 30s,则t0~t1阶段以C浓度变化表示的反应速率为v(C) = ;t1~t2的平衡常数K =。
(3)若t2~t3阶段,C的体积分数在不断地变小,则此阶段没有平衡前v(正)v(逆)(填“>”、“=”或“<”)。
(4)t5~t6阶段改变的条件为; B的起始物质的量浓度为mol/L。
滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是。
②上述滴定过程中操作滴定管的图示,正确的是。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH溶液浓度(填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是(填字母序号)。
②判断滴定终点的依据是。
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)沉淀滴定滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是(填选项字母)。
| 难溶物 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| KSP |
1.77×10-10 |
5.35×10-13 |
1.21×10-16 |
1.12×10-12 |
1.0×10-12 |
A、NaCl B、NaBrC、NaCND、Na2CrO4