硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3 mol·L-1H2SO4溶液,在60 ℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号);
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是
________________________________________________________________________;
(3)在步骤3中,“一系列操作”依次为________、________和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是________________________________________________________________________,可以观察到的现象是
________________________________________________________________________。
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
①检查装置的气密性,向装置图所示的U型管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小火加热,使其充分反应。
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为(生成的盐为NaHSO4):______________________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体化学式为__________。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的_________________(填序号)
a.苯 b.H2O c.Na2SO3溶液 d.CCl4
所需的主要玻璃仪器是______________(填仪器名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
①;③。
(2)从环保角度对两套方案的不同部分进行比较,你认为(填“甲”或“乙”)方案更合理,理由是:。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是:。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法:。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸g,需水mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的:。
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| Si |
Fe |
Cu |
Mn |
Mg |
Cr |
Zn |
Ti |
Al |
|
| 罐身/% |
0.3 |
0.7 |
0.25 |
0.25 |
1.0~1.5 |
其余 |
|||
| 罐盖/% |
0.2 |
0.35 |
0.15 |
0.2~0.5 |
4.0~5.0 |
0.1 |
0.25 |
其余 |
|
| 拉环/% |
0.2 |
0.35 |
0.15 |
0.2~0.5 |
3.0~4.0 |
0.1 |
0.25 |
0.1 |
其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H3IO6,弱酸)
【实验方案】
实验预处理:将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有。
(2)沉淀A的成分为。
(3)操作③观察到的现象为;反应的离子方程式为、
、。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)V(b)(填“>”、“<”或“=”)
I.下图表示从固体混合物中分离Q的2种方案,请回答有关问题。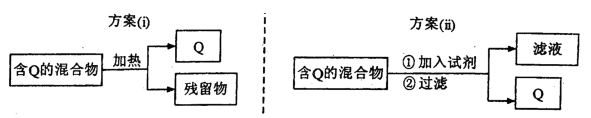
(1)选用方案(i)时,Q应该具有的性质是_____________,残留物应该具
有的性质是__________________________________。
(2)选用方案(ii)从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂为____________。
(3)为提纯某Fe2O3样品(主要杂质有SiO2.Al2O3),参照方案(i)和(ii),请设计一种以框图形式表示的实验方案(注明物质和操作):
______________________________________________________________________________。
Ⅱ.某种含有少量氧化钠的过氧化钠样品(己知样品质量为1.560g、锥形瓶和水的质量为
190.720g),利用右下图所示装置测定混合物中Na2O2的质量分数,每隔相同时间读得电
子天平的数据如下表:
(4)写出Na2O2与H2O反应的化学方程式:________________________________________.
(5)计算Na2O2质量分数时,必需的数据是_________________________________________.
不必作第6次读数的原因是_____________________________________________________.
(6)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
操作②的名称是____________,该方案需直接测定的物理量是_____________ ,测定过程中
需要的仪器有电子天平、蒸发皿、酒精灯,还需要___________、__________(固定、夹
持仪器除外),在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_______(填
“偏大”、“偏小”或“不变”)。
I、某化学课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取NO的离子方程式。
(2)查资料得知,HCOOH CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
(填序号),实验室利用该装置还可制取的常见气体有 (写一种气体的分子式)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。

①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是。
②装置(III)的主要作用是。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充装置。
II、该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol/L NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol/L的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
d.滤液中加入2 mol/L的硫酸,使其pH=2。
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
| pH |
1.5~3.2 |
6.4~8.0 |
(1)步骤b中如何检测沉淀已经洗涤干净。
(2)步骤d中加入硫酸,使其pH=2的目的是;要制得ZnSO4·7H2O的步骤d还缺少的操作是,所用的主要硅酸盐仪器是。