(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示: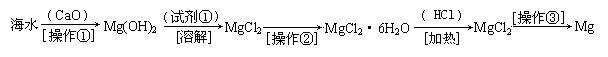
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。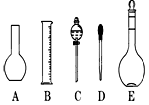
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; | B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; | D.称量碳酸钠晶体时所用砝码生锈; |
E. 定容时仰视刻度线
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。工业流程图如下:
(1)冶炼铜的总反应可看做:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__ __(填元素符号),1molCuFeS2参与反应转移电子的物质的量为 mol;
8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__ __(填元素符号),1molCuFeS2参与反应转移电子的物质的量为 mol;
(2)上述冶炼过程产生大量气体A。下列处理方案中合理的是 (填代号);
A.高空排放
B.用于制备硫酸
C.用纯碱溶液吸收制Na2SO4
D.用浓硫酸吸收
验证气体A的主要成分是SO2的方法是 ;
(3)炉渣B(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。
A.加入H2O2发生反应的离子方程式是 ;
B.除去Al3+的离子方程式是 ;
(4)选用提供的试剂,设计实验验证炉渣B中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为 ;
证明炉渣中含有FeO的实验现象为 。
某实验小组利用氯气与金属铁反应制备无水三氯化铁,经查阅资料得知:无水FeCl3在空气中易潮解,加热到100℃左右时易升华。下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置不同,分别如(I)和(Ⅱ)所示,试回答:
(1)B中反应的离子方程式为__ __;
(2)实验中a与b两个酒精灯应先点燃 ,目的是 ;
(3)收集装置(Ⅰ)的主要缺点是: ;装置(Ⅱ)也有缺点,必须采取的改进措施是:___ _。
(4)b酒精灯加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管D右端,要使沉积的FeCl3进入收集器,操作是 。
(5)实验中还缺少一个除杂装置,目的是除去 ;应选择 做除杂剂。
| A.饱和NaHCO3 | B.水 | C.饱和食盐水 | D.NaOH溶液 |
)某课外活动小组同学用右图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则A极的电极反应式为:________________________。
(2)若开始时开关K与b连接,则B极的电极反应式为:_________________________, 总反应的离子方程式为___________________。 有关上述实验,下列说法正确的是(填序号)______________
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度(饱和食盐水足量)
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。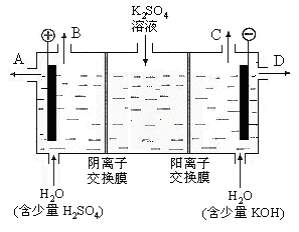
①该电解槽的阳极反应式为_____________。此时通过阴离子交换膜的离子数____________(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的硫酸溶液从出口(填写“A”、“B”、“C”、“D”)_____________导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因__________________ 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为___________________。
下图表示配制一定物质的量浓度溶液的几个关键实验步骤和操作,现欲配制230 mL 0.100 mol·L-1 Na2CO3溶液,回答下列问题:
(1)若用Na2CO3.10H2O来配制溶液,需选择________的容量瓶,用天平称取晶体 克。若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度 (填偏大、偏小或无影响)。
(2)步骤B通常称为转移,玻璃棒的作用是 ______;步骤A通常称为 ,此时应注意视线与___________、___________水平相切,如果俯视刻度线,配制的浓度_____ (填偏大、偏小或无影响);步骤结束后发现液面低于刻度线,则配制的浓度 (填偏大、偏小或无影响)。
(3)将上述实验步骤A—F按实验过程先后次序排列 。
(4)下列关于容量瓶使用的说法正确的是
| A.使用前须干燥 |
| B.使用前先检查瓶塞不漏水 |
| C.配好的溶液可以贮存在容量瓶中 |
| D.热溶液须冷却至室温才能转移入容量瓶 |
E.容量瓶用于准确配制任意体积的一定物质的量浓度的溶液
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
(1)连接上述仪器的正确顺序是:E接 , 接 , 接 , 接F。
(2)气体发生装置中进行的反应化学方程式是 ;当0.5mol MnO2参与反应时,被氧化的HCl的质量为 ,生成的Cl2在标准状况下的体积约为 。
(3)在装置中:①饱和食盐水的作用是 ,②浓硫酸的作用是 。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是 ,写出反应方程式 。
(5)写出尾气吸收装置中进行的反应的化学方程式 。