写出下列反应的热化学方程式:
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ.
下图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。B和C的相对分子质量相差16,化合物D是重要的工业原料。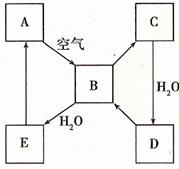
(1)单质A的名称。
(2)写出E与A的氢化物反应生成A的化学方程式___________________________。
(3)写出一个由D生成B的化学方程式____________________________________。
某同学用10mol• L-1的浓盐酸配制250mL 1mol• L-1的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
、等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为。
实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2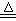 Cl2↑+MnCl2+2H2O试回答下列问题:
Cl2↑+MnCl2+2H2O试回答下列问题: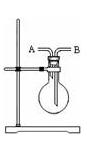
(1)该反应中是氧化剂,氧化剂和还原剂的物质的量之比为。写出该反应的离子方程式。
(2)若用右图装置收集氯气,气体应从口进入。
(3)氯气有毒、且氯气溶入水显酸性,请写出氯气溶于水的离子方程式
,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用NaOH溶液来吸收有毒的氯气,化学方程式为。
下表中有九种物质,据表回答: (12分)
| 第I 组 |
第II 组 |
第III 组 |
|
| 甲 |
BaCl2 |
Fe |
Cu(NO3)2 |
| 乙 |
Fe2O3 |
K2SO4 |
H2SO4 |
| 丙 |
Zn |
Ba(OH)2 |
MgCl2 |
(1) 第III 组中有一种物质能与第组中的所有物质反应,这种物质是.
(2) 不跟第I 组中所有物质反应且能与第III 组中所有物质反应的第II 组中的物质是,其与硫酸反应的离子方程式为;
(1)镁称为“国防金属”,常用作还原剂和脱氧剂,二氧化碳常被用作灭火剂,但是当把点燃的镁条伸入盛有CO2的集气瓶中时,镁条却能继续燃烧。请写出化学方程式。
(2)下图变化是工业制硝酸的主要途径NH3→NO→NO2→HNO3请写出NH3→NO的化学方程式。硝酸生产过程排放出来的NO是大气污染物之一。目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把NO还原成无色无毒气体直接排放到空气中,化学方程式为。