用符号A:质子数;B:中子数;C:核外电子数;D:最外层电子数;填写下列 各空。
(1)原子种类由________决定。 (2 )元素种类由________决定。
(3)相对原子质量由________决定。 (4)核电荷数由________决定
(5)元素的化 合价主要由________决定。 (6)元素的化学性质主要由________决定。
(10分)现有部分元素的性质与原子(或分子)结构如表所示:
| 元素编号 |
元素性质与原子(或分子)结构 |
| T |
最外层电子数是次外层电子数的3倍 |
| X |
常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y |
M层比K层少1个电子 |
| Z |
第三周期元素的金属离子中半径最小 |
(1)写出元素T的原子结构示意图________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填字母)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式______。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同),该原子结构示意图为_________。元素⑩名称为在周期表中的位置。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式,该化合物是由__________________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____________________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为______________________。
(9分)I.某烃类化合物A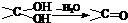 的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
| A.1H核磁共振仪 | B.质谱仪 | C.红外光谱仪 | D.元素分析仪 |
请你选择分别用什么仪器。
①测出相对分子质量(填字母代号,下同),
②测出官能团碳碳双键,
③测出几种类型的氢。
(2)结合题给信息,可以判断A的结构简式为。
II.(1)多羟基连在同一个碳原子上易自动失水生成醛或酮:,根据上述原理,请写出 与NaOH的水溶液共热的化学方程式为:。
与NaOH的水溶液共热的化学方程式为:。
(2)一个碳原子同时接两个碳碳双键不稳定, 与NaOH醇溶液共热可以生成种稳定的二烯烃。
与NaOH醇溶液共热可以生成种稳定的二烯烃。
(9分)I.按要求完成下列问题
(1) 系统命名为,
系统命名为,
(2)写出间﹣甲基苯乙烯的结构简式,
(3)2,2二甲基丙烷的习惯命名为,
(4)写出4﹣甲基﹣2﹣乙基﹣1﹣戊烯的键线式。
II.糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和A,举一例说明A物质的用途。
(2)氨基酸是组成蛋白质的基本结构单元,甘氨酸的结构简式为:NH2CH2COOH,丙氨酸的结构简式为: CH3CH(NH2)COOH。甘氨酸和丙氨酸混合发生缩合,能生成种二肽化合物。
(3)淀粉的水解产物为葡萄糖(C6H12O6),检验水解产物是葡萄糖的实验过程为:
①在淀粉中加入硫酸后加热一段时间,②加入,③加入新制Cu(OH)2溶液,煮沸。写出③的化学方程式。
(6分)0.2 mol有机物与0.5 mol O2恰好完全燃烧后的产物为CO2和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过碱石灰剩余气体被完全吸收,碱石灰质量增加17.6 g。
(1)燃烧后产物的物质的量分别为CO2________mol、H2O(g)__________mol。
(2)推断该有机物的分子式为_____________。
(3)若0.2 mol该有机物恰好与9.2 g金属钠完全反应,其核磁共振氢谱显示只有两种不同环境的H,试确定该有机物的结构简式为____________。