(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。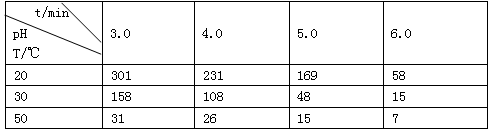
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)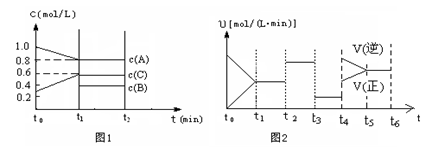
①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
| 时间段 |
t1~t2 |
t2~t3 |
t3~t4 |
t5~t6 |
| 平衡常数 |
K1 |
K2 |
K3 |
K4 |
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系 写此条件下该反应的热化学方程式 ________________
(3)工业上一般采用CO(g) + 2H2(g) 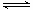 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为 ,此时的温度 250℃(填“>”、“<”、“=”)
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是: 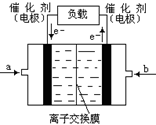
化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内________________变化来测定该反应的速率;在Na2S2O3+H2SO4→Na2SO4+S↓+SO2↑+H2O反应中,该反应的速率可通过___来测定。
某化学反应的反应物和产物如下:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2应的氧化剂是。
该反应的氧化产物是。
反应过程中转移5mole,生成标况下N2的体积L。
配平该反应的化学方程式:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白,并利用三段式写出①②的计算过程。
①从开始反应至达到平衡状态,求反应物A的平均反应速率和A的转化率。
②求x的值和t℃该反应的平衡常数K的值。
③若向原平衡混合物的容器中再充入4 mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=mol。
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为_________mol/(L·min)。
(2)在实验2,A的初始浓度c2=_________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_________。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3_________υ1(填>、=、<),且c3_________1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由是:
______________________________________________________________________
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下 列问题:
⑴从实验装置上看,图中尚缺少的一种玻璃用品是。
⑵烧杯间填满碎纸条的作用是。
⑶如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由。
⑷用相同浓度和体积的醋酸溶液代替盐酸进行上述实验,测得的中和热ΔH会。(填“偏大”、“偏小”、“无影响”)