1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 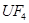 +
+  ——
——  +
+ 
②  +
+  ——
——  +
+ 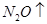 +
+ 
甲烷作为一种新能源在化工领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ;ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ;ΔH=﹣566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为: _____________________.
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a处应通入_____(填“CH4”或“O2”),b处电极上发生的电极反应式是:
②电镀结束后,装置Ⅰ中溶液的pH值_____(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 .
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH―以外还含有_____(忽略水解).
④在此过程中若完全反应,装置Ⅱ中阴极质量变化为12.8 g,则装置Ⅰ中理论上消耗甲烷_______L(标准状况下).
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① |
HF |
Ka=6.8×10-4 mol•L-1 |
| ② |
CH3COOH |
Ka=1.7×10-5 mol•L-1 |
| ③ |
HCN |
Ka=6.2×10-10 mol•L-1 |
| ④ |
H2CO3 |
Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最弱的是_____________.
(2)写出H2CO3电离方程式是 .
(3)写出反应的化学方程式:足量的氢氟酸与碳酸钠溶液混合: ,少量的CO2通入NaCN溶液中: .
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空: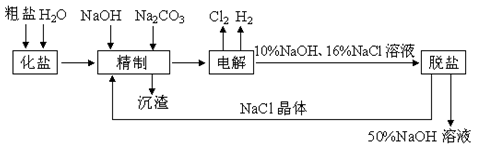

(1)在电解过程中,与电源正极相连的电极上电极反应式为________________,与电源负极相连的电极附近,溶液pH值________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是____。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为____(选填a、b、c)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却结晶、________(填写操作名称)除去NaCl.
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
(1)将部分粉末加入水中,振荡,有白色沉淀生成;
(2)向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
(3)取少量(2)的溶液滴入AgNO3溶液,有白色沉淀生成。
根据上述实验现象,判断原白色粉末中肯定含有 (填化学式,下同),可能含有 ,写出步骤(3)中发生反应的离子方程式: 。
四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,该反应的氧化剂是 ,当1mol C参与反应时转移 mol电子,请用双线桥描述S+2KNO3+3C=K2S+N2↑+3CO2↑电子转移情况 。