为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。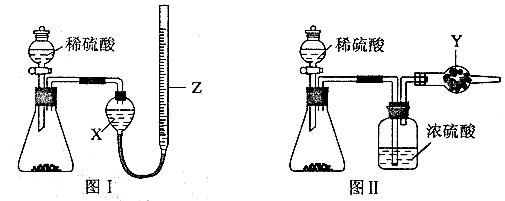
(l)盛放稀硫酸的仪器名称为 。
(2)试剂X为____ ;试剂Y为____ 。
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) 。
A.读数前应使整套装置冷却至室温
B.调整Z的高度使量气装置左右液面相平
C.读数时视线与Z内凹液面最低点相切
D.读数前应通入一定量的N2使生成的CO2全部进入量气装置
(4)按乙同学的实验方案进行实验,使测得的Na2CO3的质量分数偏高的因素有(写一种)
,使测得的Na2CO3的质量分数偏低的因素有(写一种)________ 。
(5)为完成相同的测定任务,下列实验方案不能达到实验目的的是 (填选项字母)。
A.取mg混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干得ng固体
B.取mg混合物与足量盐酸充分反应,将溶液加热、蒸干、灼烧得ng固体
C.取mg混合物充分加热,固体质量减少ng
D.将图II装置中的稀硫酸改为稀盐酸进行实验
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下: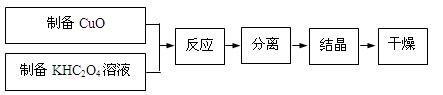
(已知:H2C2O4 CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①用双层滤纸过滤的原因是。
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净。
(2)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中;50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,而不用KOH粉末代替K2CO3粉末,其主要原因是。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;
b.。
②在蒸发浓缩的初始阶段还采用了如图所示的装置,其目的是。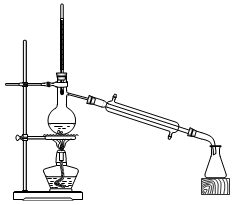
苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。
反应原理: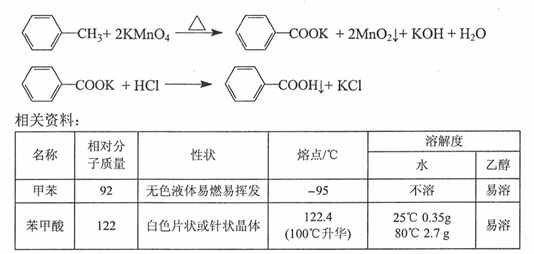
实验步骤:
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯。
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)三颈烧瓶所盛液体体积通常占其容积的1/3--2/3,则本实验应选择的三颈烧瓶规格为(填字母序号)。
| A.100 mL | B.250 mL | C.500 mL | D.1000 mL |
(2)判断甲苯己完全反应的现象是、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是;苯甲酸粗产品除了可用重结晶法精制外,还可用法。
(4)写出碱性高锰酸钾溶液与亚硫酸氢钠反应生成黑色沉淀的离子方程式。
(5)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL.V2="24.80" mL.V3= 25.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是。
②若用酚酞作指示剂,确定滴定终点的现象是。
③产品的纯度为。
(共16分)硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用。它们对应的钠盐同样也是重要的化工产品。
(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)= Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)= 3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:_______________________________。
装置D的作用是。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是__________________。
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”)。
其原因是(用化学方程式表示)
锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是___________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下: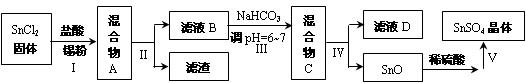
①步骤Ⅰ加入Sn粉的作用: ________________________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、_______________、______________。
③步骤Ⅲ生成SnO的离子方程式:____________________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是______________________________,证明已洗净。
⑤步骤Ⅴ操作依次为_____________、____________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是__________。
利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是_____________________________________。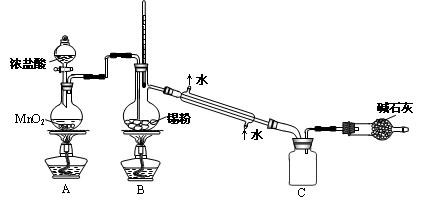
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
| 相对分子质量 |
沸点/℃ |
密度/(g/cm3) |
水中的溶解性 |
|
| 正丁醇 |
74 |
117.2 |
0.8109 |
微溶 |
| 正丁醚 |
130 |
142.0 |
0.7704 |
几乎不溶 |

①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加。
(2)加热A前,需先从(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去,振摇后静置,粗产物应(填“上”或“下”)口倒出。
(4)步骤③中最后一次水洗的目的为。
(5)步骤⑤中,加热蒸馏时应收集(填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为,下层液体的主要成分为。
(7)本实验中,正丁醚的产率为(精确到1%)。