如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: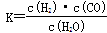 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度(mol/L) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)=
②比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 (填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) →2NO (g) -180.8 kJ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
【化学——选修3:物质结构与性质】
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
(1)基态铜原子的外围电子层排布为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。
【化学——选修2:化学与技术】
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3=Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)=。
(4)“沉淀”中含杂质离子主要有;“操作X”名称为。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为价。若放电时有1mole-转移,正极质量增加g。
CoO2+ LiC6。LiC6中Li的化合价为价。若放电时有1mole-转移,正极质量增加g。
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为(保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①计算该反应第一次达平衡时的平衡常数K。
②3min时改变的反应条件是(只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为。
某工厂废弃的钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,现从该钒渣回收V2O5的工艺流程示意图如下:
(已知:沉淀为(NH4)2V6O16,全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层) + nH2SO4(水层)
2RAn(有机层) + nH2SO4(水层)
回答下列问题:
(1)(NH4)2V6O16中钒(V)的化合价为,①中产生的废渣的主要成分是。
(2)工艺中反萃取所用的X试剂为。
(3)为提高②中萃取效率,应采取的措施是。
(4)请完成④中的反应离子方程式:
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:。
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,装置如下:
b为电解池的极,全钒液流储能电池正极的电极反应式为;
若通过消毒液发生器的电子为0.2 mol,则消毒液发生器中理论上最多能产生gNaClO。
、资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=" -76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H="+113.4" kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g) 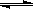 C H4 (g)+2 H2O(g)
C H4 (g)+2 H2O(g)
向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________________。 200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: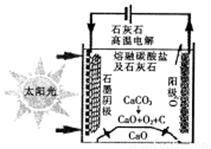
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能 d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-
则阳极的电极反应式为___________________。