工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
||
| 500 |
700 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.34 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
1.70 |
2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
|
|
|
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时V正 V逆(填“ > ”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是_____________(填序号)。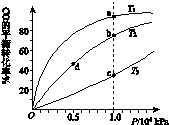
A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c) , υ(b)>υ(d)
C.平衡常数:K(a)>K(c) , K(b)=K(d)
D.平均摩尔质量:M(a)>M(c) , M(b)>M(d)
【化学选修2—化学与技术】电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。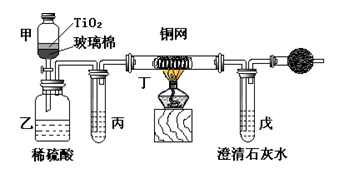
回答下列问题:
(1)乙中反应的离子方程式为 ,氧化产物是 ;
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是 (填字母),原因是 ;
a.饱和食盐水 b.饱和NaHCO3溶液 c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是 ,原理是 ;
(4)干燥管中装有物质是 ,作用是 ;
(5)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 ,请说明该测得值与实际处理的百分率相比偏高还是偏低 ;
(6)请提出两个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) , 。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
3.041 |
1.000 |
0.120 |
由表中数据判断ΔH________0 (填“>”、“=”或“<”),化学平衡常数表达式K= ;
(2)300 ℃时,在体积为2.0 L的密闭容器中通入2 mol CO和4 mol H2 ,经过20 s 达到平衡状态,
①计算20 s内CO的反应速率为 ,此时容器中甲醇的体积分数为 ;
②若向上述平衡体系中同时加入1mol CO,2mol H2 和1mol CH3OH气体,平衡移动情况是__________(填“向右”、“向左”或“不移动”),原因是 ;
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1=-1277.0 kJ/mol
②2CO(g)+O2(g) = 2CO2(g)ΔH2=-566.0kJ/mol
③H2O(g) = H2O(l)ΔH3=-44 kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)甲醇,氧气可制作燃料电池,写出以氢氧化钾为电解质甲醇燃料电池负极反应式 ;如图,电解KI溶液制碘,在粗试管中加入饱和的KI溶液,然后再加入苯,插入一根石墨电极和一根铁电极,使用该燃料电池做电源,铁电极与 极(填正或负)相连接,通电一段时间后,断开电源,振荡试管,上层溶液为 色,当有1.27g 碘单质生成时,需要 g CH3OH。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式 ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 |
1 |
2 |
3 |
4 |
| V(Na2S2O3)(mL) |
28.32 |
25.31 |
25.30 |
25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除
尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH |
沉淀完全的pH |
|
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
CO的制备原理:HCOOH CO↑+H2O,CO的制备装置如图所示。请填写下列空白:
CO↑+H2O,CO的制备装置如图所示。请填写下列空白:
(1)装置a的作用是 ;
(2)实验时向装置b中加入几粒沸石的作用是 ,某同学进行实验时,加热后发现未加沸石,应采取的正确方法是 ;
(3)装置c的作用是 ;
(4)实验室用浓硫酸和2-丙醇制备丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是④—_______—_______—_______—②(填序号,试剂可以重复使用);
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
写出生成SO2、CO2及水蒸气反应的化学方程式 ;
(5)合成的1-丁醇中常含有杂质丁醛,设计出如下提纯路线:
已知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚 34℃,1-丁醇 118℃
试剂1为 ,操作1为 ,操作2为 ,操作3为 ;
(6)现用60g 2-丙醇制备1-丁醇,经分析知:由2-丙醇制备丙烯时的产率为85℅,由丙烯制丁醛产率为80℅,由丁醛制1-丁醇产率为75℅,则制得1-丁醇为 g。
某些天然气开采中含有H2S气体,为了安全、有效地利用这一资源,提高经济价值,工业上可以采取多种处理方式。
Ⅰ.吸收:
(1)加工过程中常用氨水吸收H2S,产物为NH4HS,请写出对应的化学方程式: 。
Ⅱ.再利用:加工过程中产生的H2S废气可用来制H2,既廉价又环保。工业上采用以下两种方法制备H2
1高温热分解法
已知:H2S(g) H2(g)+S(g)△H
H2(g)+S(g)△H
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。请回答:
(2)△H 0(填 “>”或者“<”),你判断的依据是: 。
ii.图中a为H2S的平衡转化率与温度关系曲线,
(3)据图计算985℃时H2S按上述反应分解的平衡常数K=________
2电化学法
已知:该法制氢过程的示意图如右,FeCl3溶液可作为H2S的吸收液。
请回答:
(4)反应池中发生反应的离子方程式为_____________。
(5)请结合化学用语解释说明该装置能够产生H2的原因 。
(6)该装置除了能够制氢外,还具有何种优点?请你评价 。