氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l) 3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1,若该反应中有4mol N—H键断裂,则形成的
3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1,若该反应中有4mol N—H键断裂,则形成的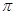 键有 mol。
键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___ 。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
(1)铷37Rb位于周期表的第________周期、第________族。
(2)关于铷的结构和性质判断正确的是________。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁原子相同
⑤它是还原剂
A.①③④ B.②③⑤ C.②④ D.①③⑤
(3)氢化铷与水反应可放出氢气,则下列叙述正确的是________。
A.氢化铷溶于水显酸性
B.氢化铷中氢离子被还原为氢气
C.氢化铷与水反应时,水是还原剂
D.氢化铷中氢离子最外层有两个电子
(4)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________。
A.LiB.NaC.KD.Cs
(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
【化学—物质结构与性质】
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。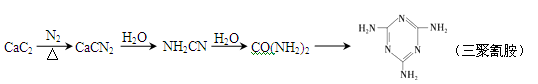
(1)CO(NH2)2分子中含有σ键的个数为______。CaCN2中阴离子为CN22-,与CN22-离子互为等电子体的分子的化学式为_______,可推知CN22-的空间构型为_________。
(2)三聚氰胺在动物体内可转化为三聚氰酸( ),三聚氰酸分子中N原子采取______杂化。三聚氰胺与三聚氰酸的分子相互之间通过________结合,在肾脏内易形成结石。
),三聚氰酸分子中N原子采取______杂化。三聚氰胺与三聚氰酸的分子相互之间通过________结合,在肾脏内易形成结石。
(3)下图是电石的晶胞示意图,则一个晶胞中含有___个Ca2+离子,研究表明,C22-的存在使晶胞呈长方体,该晶胞中一个Ca2+周围距离相等且最近的C22-有___个。
【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材b.石墨c.铅板d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液b.Zn(NO3)2溶液c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。