下面给出了四种有机物A、B、C、D的相关信息:
①烃A在所有的烃中含碳的质量分数最低
②烃B是一种植物生长调节剂,可用于催熟果实
③烃C在氧气中燃烧产生的氧炔焰常用来切割或焊接金属
④医疗上常用体积分数为75%的D溶液来消毒
据此回答有关问题:
(1)将A和Cl2混合充入一试管,密封后置于光亮处,一段时间后能看到试管内壁上出现的油状物不可能是__________(填编号)。
A.CH3Cl B.CH2Cl2 C.CHCl3 D.CCl4
(2)实验室制取B,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气体中含有B和SO2。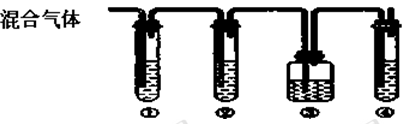
I.装置可盛放的试剂是:②: ④: (请将下列有关试剂的序号填入空格内)
A、品红 B、NaOH溶液 C、浓硫酸 D、酸性KMnO4溶液
Ⅱ.确定含有B的现象是 。
(3)烃C的结构式为 。
(4)D中加入冰醋酸、浓硫酸和少量H218O加热一段时间后,18O存在于
①存在于冰醋酸和水分子中 ②只存在于水分子中
③存在于D和冰醋酸分子中 ④存在于冰醋酸和D与醋酸形成的酯分子中
以HCHO和C2H2为有机原料,经过下列反应可得化合物N(C4H8O2)。
(1)反应Ⅰ的反应类型为______________。
(2)HOCH2C≡CCH2OH分子的核磁共振氢谱有_______个吸收峰。
(3)化合物M不可能发生的反应是____________(填序号)。
| A.氧化反应 |
| B.取代反应 |
| C.消去反应 |
| D.加成反应 |
E.还原反应
(4)N的同分异构体中,属于酯类的有________种。
(5)A与M互为同分异构体,有如下转化关系。其中E的结构简式为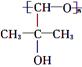
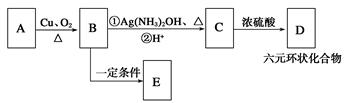
填写下列空白:
①A的结构简式为____________________,B中的官能团名称是____________。
②D的分子式为__________________。
③写出B与银氨溶液反应的化学方程式:。
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400 ℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式__________________。K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是__________________。
(2)CN-中碳原子的杂化方式为____________;1 mol CN-中含有π键的数目为__________。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为______________。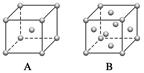
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为________________。
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下: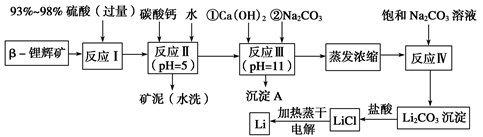
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:__________________________。
(2)反应Ⅱ加入碳酸钙的作用是__________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:________________________。
(4)洗涤所得Li2CO3沉淀要使用________(选填“热水”或“冷水”),你选择的理由是__________________________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是
________________________________________。
甲醇是一种重要的化工原料和新型燃料。
Ⅰ.以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) ΔH=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式。
Ⅱ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:
CO(g)+2H2(g) 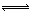 CH3OH(g) ΔH=-90.8 kJ·mol-1
CH3OH(g) ΔH=-90.8 kJ·mol-1
在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数的表达式为;若增大H2的用量,上述反应的热效应最大值为____________kJ。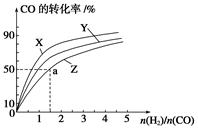
Ⅲ.下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。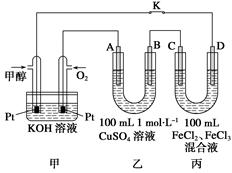
(1)甲中负极的电极反应式为________。
(2)乙中A极析出的气体在标准状况下的体积为________________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图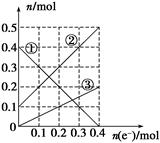
则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1)实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式:。
工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3溶液反应后生成碘,写出此反应的离子方程式:。
(2)单质碘与氟气反应可制得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O H3O++OH-),生成的阳离子为IF4+,则阴离子为。
H3O++OH-),生成的阳离子为IF4+,则阴离子为。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体(AlI3),此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出AlI3和Na2CO3溶液反应的离子方程式:。
(4)设计以下实验方案判断加碘食盐中碘的存在形式为I-、IO3-,或两者同时存在。请对以下试验方案进行预测和分析。
首先取试样加水溶解,分成三份试样:
①第一份试样加酸酸化,如果加淀粉溶液后试样溶液变蓝,说明试样中同时存在I-和IO3-,该过程反应的离子方程式为。
②第二份试样酸化后加溶液,如果加入淀粉溶液后试样溶液变蓝,说明试样中存在I-。
③第三份试样酸化后,如果直接使试纸变蓝,说明试样存在IO3-离子。