某探究小组用测量HNO3与大理石反应过程中因二氧化碳逸出质量减小的方法,研究影响反应速率的因素。限选试剂:(实验过程中不考虑稀硝酸的挥发)
1.0mol·L-1 HNO3、2.0mol·L-1 HNO3、细颗粒大理石、粗颗粒大理石、35 ℃水浴
(1)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 |
T/℃ |
大理石规格 |
HNO3浓度/mol·L-1 |
| ① |
常温 |
粗颗粒大理石 |
|
| ② |
常温 |
粗颗粒大理石 |
2.0 |
| ③ |
|
粗颗粒大理石 |
2.0 |
| ④ |
常温 |
|
2.0 |
以上表格中实验①、③、④空格处应填 、 、 。
(2)整个实验中应控制的不变量是硝酸溶液体积和 。
(3)该实验小组用如图实验装置进行实验。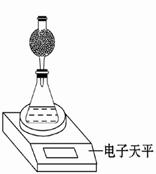
①除电子天平、干燥管、胶头滴管、秒表、玻璃棒、锥形瓶、药匙、胶塞等仪器外,必需的玻璃仪器还有 。
②干燥管中应放置的试剂是 。
A.碱石灰 B.无水CaCl2固体
C.生石灰 D.浓硫酸
③若撤除干燥管装置,所测速率 (填“偏大”、“偏小”或“不变”)。
溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下: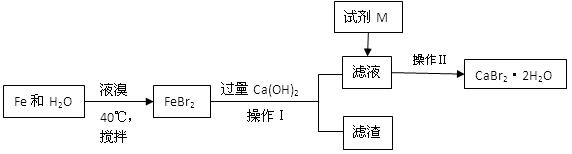
(1)与液溴的反应温度不能超过40℃的原因是。
(2)滤渣的成分可能是。
(3)试剂M是,加入M的目的是。
(4)操作Ⅱ的步骤为蒸发浓缩、、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为。(相对原子质量:Ca—40 Br—80 H—1 O—16)
[选修2—化学与技术]金属钒被誉为“合金的维生素”,钒及其化合物在工业生产中有着广泛的应用。从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的生产流程图如下:
请回答:
(1)进行步骤①前,将废钒催化剂粉碎的目的是。写出步骤①中发生氧化还原反应的离子方程式。
(2)实验室中进行萃取分液操作时,用到的玻璃仪器有。②③变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层) + n H2SO4(水层),为提高②中萃取百分率,应采取的措施是____;
2RAn(有机层) + n H2SO4(水层),为提高②中萃取百分率,应采取的措施是____;
(3)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
通过上表数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为______;
(4)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如下图所示,则NH4VO3在分解过程中。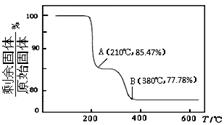
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
(5)全钒液储能电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ VO2++H2O+V3+,电池放电时正极的电极反应式为。
VO2++H2O+V3+,电池放电时正极的电极反应式为。
(15分)三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到。
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解。实验室制取PCl3的装置示意图和有关数据如下: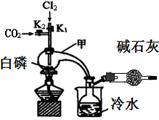
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
| 白磷 |
44.1 |
280.5 |
1.82 |
| PCl3 |
-112 |
75.5 |
1.574 |
| POCl3 |
2 |
105.3 |
1.675 |
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有。制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥
的(写出操作、现象、结论)。
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是。
(3)E烧杯中加入冷水的目的是,干燥管中碱石灰的作用是。
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有(填字母序号)。
A.萃取 B.过滤C.蒸馏D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是(已知亚磷酸(H3PO3)是二元弱酸)。
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下: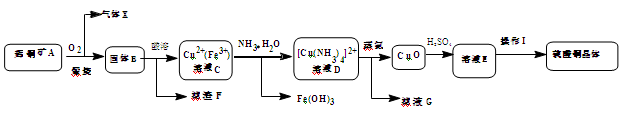
已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)
Cu2+(aq) + 4NH3(aq)
(1)气体X是,高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为:。
(2)固体B酸溶时加入稀硫酸和H2O2,目的是,不用浓硫酸的原因是。
(3)鉴别溶液D中Fe3+完全除尽的方法是。滤液G的主要溶质是(填化学式)。
(4)由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、、烘干。
(5)用“间接碘量法”测定所制备的CuSO4·5H2O(不含能与I-反应的氧化性杂质)的纯度。取a g试样配成100 mL溶液,取25.00 mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,滴加KI溶液至沉淀不再产生为止,然后用硫代硫酸钠标准溶液滴定生成的I2,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,消耗c mol·L-1 Na2S2O3溶液的体积为V mL。
①写出CuSO4与KI反应的离子方程式_________________________。
②计算试样中CuSO4·5H2O的纯度____________________(用a、c、V表示)。
(15分)过硫酸钠( Na2S2O8)是一种重要化工原料。某研究小组进行如下实验
实验一过硫酸钠的制取
采用下图装置制取Na2S2O8。
装置I中:主反应:(NH4)2S2O8 +2NaOH Na2S2O8+2NH3↑+2H2o
Na2S2O8+2NH3↑+2H2o
副反应:①2NH3+3Na2S2O8十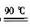 6NaOH===6Na2SO4 +6H2o十N2
6NaOH===6Na2SO4 +6H2o十N2
②3Na2S2O8 +3H2O+3Na2SO4+3H2SO4 +O3 ↑
(1)装置Ⅱ的作用是。
(2)装置I还需补充的实验仪器或装置有_(填序号)。
a.温度计b.酒精灯 c.水浴 d.洗气瓶
(3)装置I发生反应的同时需要持续通入氮气的目的是
实验二过硫酸钠的性质实验
(4)为研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据是 。
(5)Na2S2O8溶液与铜反应时先慢后快,除反应放热这一因素外,有人认为还有一种可能是反应生成的Cu2+对后续反应起催化作用,能检验该说法是否正确的实验方案为。
实验三过硫酸钠的应用研究
(6)为检验用Na2S2O8溶液吸收NO的可行性,某同学设计下图所示实验(已知NO不溶于NaOH溶液)。实验步骤如下:
i.检查装置气密性,并按下图加人试剂;
ii.打开a和d,通人足量N2,关闭d;
iii.往装置中通人适量NO,关闭a;
iv.....
①步骤iv中,对分液漏斗的操作是_。
②能证明该方案可行的实验现象是_。