辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: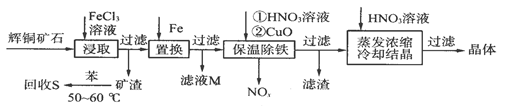
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
(本题16分)为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。
已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:
(1)稀硝酸和Cu反应的化学方程式为。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①根据实验现象写出发生反应的离子方程式:。
②导致实验过程中溶液pH略有上升的可能原因是。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:。
(本题16分) 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有______(选填字母)
| A |
B |
C |
D |
|
| n(CO2)/mol |
3 |
1 |
0 |
1 |
| n(H2)/mol |
2 |
1 |
0 |
1 |
| n(CO)/mol |
1 |
2 |
3 |
0.5 |
| n(H2O)/mol |
5 |
2 |
3 |
2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是__________。
(本题16分)三氧化二镍(Ni2O3)可用于制造高能电池。一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3。其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。右图为电解装置示意图,电解池两极用阳离子交换膜隔开。请回答下列问题: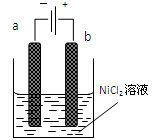
(1)该电解池的阳极材料可选用________(填序号)
| A.铁 | B.Cu | C.石墨 | D.镍 |
(2)加放适量硫酸钠的作用是:_______________________________________________
(3)电解过程中,阴极附近溶液的pH_____,阳极附近溶液的pH_____(填“升高”、“不变”、“降低”)。
(4)写出Ni2+转化为Ni3+的离子方程式:_______________________________________
(5)铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O 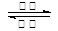 Fe(OH)2+2Ni(OH)2。
Fe(OH)2+2Ni(OH)2。
写出下列电极反应式:
①放电时的正极:___________________________________________________________
②充电时的阴极:___________________________________________________________
(6)电池充电时,电池的负极应接外电源的_____________(填正极或负极)
(本题16分)硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)和副产物石膏(CaSO4•2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表:
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
| 石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
| 胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是____________。
(2)写出浸出过程中生成硫酸铜的离子方程式 _______________________________。
(3)操作I包括加热升温、控制温度在_______℃、蒸发结晶、__________等操作。
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为_________、过滤、洗涤、干燥;
(5)用无水乙醇洗涤晶体而不用蒸馏水的原因是________________________________;
(6)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品进行以下操作:
方案一:取样于试管→滴加KSCN溶液;方案二:纸上层析后→喷KSCN溶液;
①你认为上述两种方案设计更合理的是_____________;
②指出你认为不合理的方案存在的问题_____________________________________。
(本题共16分)下表为元素周期表的一部分,请用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)④、⑤、⑥的原子半径由大到小的顺序为____________________(用元素符号表示)。
(2)请用化学方程式表示非金属性:④>③_________________。
(3)表中①、③、④三种元素组成的常见化合物中能促进水的电离的是__________(用化学式回答,下同),能抑制水的电离的是___________。
(4)由表中元素①③④⑥⑨形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_________________________。
(5)由④、⑤、⑧三中元素形成的两种盐溶液中,加入盐酸发生氧化还原反应的离子方程式是。