资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g)= NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s)= CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l)= H2O(g) △H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式 。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L—1,H2:0.8mol·L—1,CH4:0.8mol·L—1,H2O:1.6mol·L—1,起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g) ,300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
①上述生产过程的能量转化方式是 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
四种同类有机物A、B、C、D,它们的分子式均为C4H10O。已知A可被氧化为E,B可被氧化成F,C除可燃烧之外难以被氧化,A和C分别脱水后得到同一种不饱和烃,E和F都可发生银镜反应。
(1)D结构简式,F中所含官能团的结构式
(2)写出下列反应的化学方程式:(注明反应条件)
A → E:
C分子内脱水:
E发生银镜反应:
聚丙烯酸钠(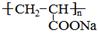 )是一种强吸水树脂。由某烃A合成聚丙烯酸钠的流程如下:
)是一种强吸水树脂。由某烃A合成聚丙烯酸钠的流程如下:
(1)A的名称为,B中官能团的名称是。
(2)物质E的结构简式是。
(3)反应②、③的反应类型分别为、。
(4)反应①发生的化学方程式为。
(5)写出符合下列条件的F的同分异构体(不考虑顺反异构)的结构简式。
a. 链状分子
b. 与新制氢氧化铜在加热条件下反应生成红色沉淀
c. 与NaOH溶液混合后滴入酚酞,加热,溶液颜色变浅
分子式为C8H13O2Cl的有机物A发生如图所示的变化: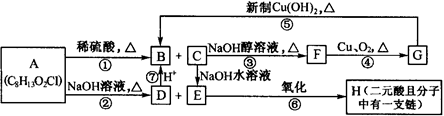
请回答下列问题:
(1)反应①和③的反应类型分别为:、
(2)请写出下列物质的结构简式: B; C
(3)请写出F与H等物质的量发生反应的化学方程式:
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是______________________。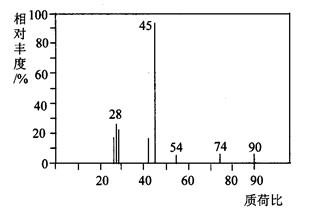
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是__________________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是___________________________________________________________________。
肉桂醛(C9H8O)是一种常用香精,在食品、医药化工等方面都有应用。肉桂醛与其他有机物具有如下转化关系,其中A为一氯代烃。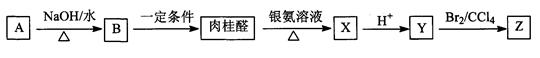
(1)肉桂醛是苯的一取代物,与H2加成的产物中没有支链,肉桂醛结构简式是_______。
(2)反应A→B的化学方程式是_____________________________________________。
(3)Z不能发生的反应类型是(填字母)___________。
a. 取代反应 b. 加聚反应 c. 加成反应 d. 消去反应
(4)Y与乙醇在一定条件下反应的化学方程式是
___________________________________________________________________。
(5)写出符合下列条件的Y的一种同分异构体的结构简式:
___________________________________________________________________。
①属于酯类 ②苯环上只有一个取代基 ③能发生银镜反应。