高纯超微细草酸亚铁可用于合成新型锂电池电极材料,工业上可利用提取钛白粉的副产品绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4
Fe(OH)2+H2C2O4=FeC2O4+2H2O
(1)绿矾中含有一定量的TiOSO4杂质。将绿矾溶于稀硫酸,加入铁粉、搅拌、充分反应并保持一段时间,过滤,可得纯净的FeSO4溶液。在上述过程中,TiOSO4能与水反应转化为H2TiO3沉淀,写出该反应的化学方程式: ;加入铁粉的作用有 、 。
(2)由纯净的FeSO4溶液制取FeC2O4时,需在真空环境下进行,原因是 。
FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致
FeC2O4的产率 (填“偏高”、“偏低”或“无影响”)。
(3)将含有FeC2O4的混合液过滤,将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 、 。
(4)某研究小组欲从某化工残渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4。请补充完整由该化工残渣制备较纯净的FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量该化工残渣中加入足量的稀硫酸充分反应,过滤, ,过滤,得到较纯净的FeSO4溶液。
根据下面的反应路线及所给信息填空.
(1)A的结构简式是____________,名称是________.
(2)①的反应类型是______________;②的反应类型是______________.
(3)反应④的化学方程式是____________________________________________.
为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验: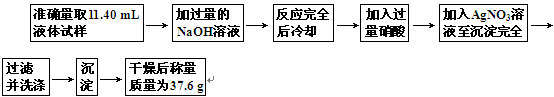
回答下列问题:
(1)准确量取11.40 mL液体所用仪器是________;
(2)加入过量硝酸的作用是__________________________________________________;
(3)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是________;
(4)已知此卤代烃液体的密度是1.65 g/mL,其蒸气对甲烷的相对密度是11.75,则此每个卤代烃分子中卤原子的数目为________;此卤代烃的结构简式为________.
在有机反应中,反应物相同而条件不同会得到不同的主产物.下式中R代表烃基,副产物均已略去.
(请注意H和Br所加成的位置)
写出实现下列转变的各步反应的化学方程式,注意写明反应条件.
(1)由CH3CH2CH2CH2Br分两步转变为
CH3CH2CHBrCH3;
(2)由(CH3)2CHCH===CH2分两步转变为
(CH3)2CHCH2CH2OH.
C3H7Cl的结构有两种,分别为CH3CH2CH2Cl和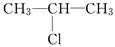
(1)CH3CH2CH2Cl在NaOH水溶液中受热反应的化学方程式是________________________________________________________________________,
反应类型为________.
(2) 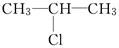 在NaOH乙醇溶液中受热反应的化学方程式是
在NaOH乙醇溶液中受热反应的化学方程式是
________________________________________________________________________,
反应类型为________.
比赛中,当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理.乙烯和氯化氢在一定条件下制得氯乙烷的化学方程式(有机物用结构简式表示)是____________________________.该反应的类型是________反应.决定氯乙烷能用于冷冻麻醉应急处理的具体性质是___________________.