闪锌矿(主要成份为ZnS)是含锌主要矿物之一,空气中高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。回答下列问题(以下计算保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留
固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70 mL。
①反应后溶液中多余的硫酸是____________ mol。
②通过计算确定浓硫酸被还原的产物是________________________。
(3)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
根据下列表示物质组成的微观示意图,回答下列问题。
(1)表示混合物的是;
(2)表示单质的是;
(3)表示由原子直接构成的物质的是。
下图中, 表示氧原子,
表示氧原子,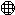 表示氢原子。根据此图,请从宏观、微观两个方面写出获得的化学信息。(可不填满,也可补充)
表示氢原子。根据此图,请从宏观、微观两个方面写出获得的化学信息。(可不填满,也可补充)
(1)_____________________________________________
(2)_____________________________________________
(3)_____________________________________________
(4)_____________________________________________
据报道,2001年5月26日中午,广东湛江发生一起浓硫酸泄漏事件,防化兵采取的有效措施是:首先挖坑疏导浓硫酸液体,同时紧急调用10t烧碱与浓硫酸发生反应,其反应的化学方程式为。防化兵当时能否调用熟石灰来代替烧碱?
苏丹红是—类染色剂。在我们日常接触的物品中,家用的红色地板漆或红色鞋油通常含有苏丹红的成分。根据2004年4月MSDS提供的数据,苏丹红存在有限的致癌作用,不可服用。2005年2月23日中国政府发布紧急公告,禁止苏丹红作为食品添加剂。下表是苏丹红1号的有关信息:
| 编号 |
化学式 |
C16H12N2O |
| ① |
外观 |
暗红色或深黄色片状晶体 |
| ② |
溶解度 |
在水中:<0.01g/100mL;汽油中:任意比例互溶。 |
| ③ |
熔点 |
404~406℃ |
| ④ |
沸点 |
475℃ |
| ⑤ |
致癌原因 |
在人体内分解出一种有毒的有机物(苯胺) |
试回答下列问题:
(1)苏丹红l号中含有种元素,各元素原子的物质的量比为nC:nH∶nN∶nO=,其中氮元素的质量分数为(结果保留一位小数)。
(2)在上表给出的信息中,属于苏丹红1号物理性质的有(填编号)。
(3)苏丹红l号对动物和人体有致癌作用,主要是因为该物质在体内发生了(填“物理”或“化学”)变化。
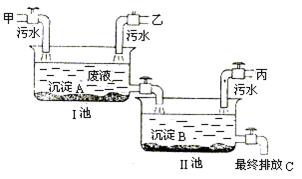
2003年6月5日世界环境日的主题是:“水——二十亿人生命之所系”。节约用水,防治水污染具有十分重要的意义。某工厂有甲、乙、丙三个车间,各自排放的污水中均无沉淀物。各车间的污水分别含有以下六种物质中的各两种:KOH、K2SO4、AgNO3、Ba(NO3)2、KCl、HNO3。为防止污染水源,某中学化学兴趣小组配合工厂分别用石蕊试液和氯化钡溶液进行污水检测,现象如下:
甲:蓝色(石蕊试液)、白色沉淀(氯化钡溶液);乙:紫色(石蕊试液)、无明显现象(氯化钡溶液);丙:红色(石蕊试液)、白色沉淀(氯化钡溶液)。
由此可确定丙车间排放的污水中含有和。为变害为利,化学兴趣小组与工厂研究设计如下图污水处理方案。请回答:沉淀A是,若各步处理均完全反应,最终排放液C的溶质是,在农业上它可用作复合肥料。