选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法;B加热分解;C结晶法;D分液法;E蒸馏法;F过滤法
(1)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(2)分离水和汽油的混合物;
(3)分离饱和食盐水与泥沙的混合物;
(4)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物;
氢氧化钠是一种用途十分广泛的化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是__________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽的①电解时电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来的2倍的是________________。
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为________,原因是___________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: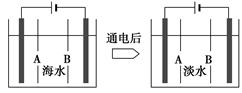
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
水是生命之源,也是重要的环境要素之一。
(1)观察下图(Ⅰ),若用1 L水来代表地球上的总水量,要比较精确地量取地球上的淡水量,应选择的仪器是__________。
| A.100 mL烧杯 | B.50 mL烧杯 | C.100 mL量筒 | D.50 mL量筒 |

(2)图(Ⅱ)是某居民小区中垃圾收集点(小圈)的布局,它在选址上存在的问题有________;垃圾收集点选址应考虑的因素包括__________________________
(3)有人设想在住宅小区附近建立小型生活垃圾焚烧厂,其流程如图(Ⅲ)。请将图(Ⅲ)中①②③所要表达的内容填在下面的横线上。
图(Ⅲ)
①______________________________;
②________________________________;
③_________________________________。
工厂的工业废水,不可直接往江河湖海中排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_______________________________。
(2)乙厂污水中含有的四种离子可能是:______________________________。
(3)对乙厂废水进行处理,方法之一,可往废水中加入一定量的________(选填
“活性碳”“硫酸亚铁”或“铁粉”),可以回收其中的金属__________(填
元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水中的________(填离子符号)转化为沉淀,从而大大降低污染程度。过滤后所得废水主要含________,可用于浇灌农田。
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物。可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是( )。
| A.③①④② | B.①③④② | C.④②①③ | D.④②③① |