溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| |
苯 |
溴 |
溴苯 |
| 密度/(g·cm-3) |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
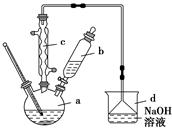
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴液溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完,装置d的作用是___________________________________________
_____________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,NaOH溶液洗涤的作用是_____________________________________________________
___________________。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________________________________________________________。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入序号)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填序号)。
A.25 mL B.50 Ml C.250 mL D.500 mL
有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→G,G→麻黄碱的部分反应物和条件):
请回答下列问题:
(1)关于麻黄碱下列说法正确的是(填字母)。
a.麻黄碱的分子式为C10H15NO
b.1mol麻黄碱可以对应消耗1molHCl或NaOH
c.麻黄碱可以发生消去和酯化反应
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量之比为42:3:8,
则A的含氧官能团名称是;检验该官能团的实验是。
(3)反应①~⑤中属于取代反应的是(填序号)。
(4)写出D—B的化学方程式。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式。
(6)写出符合下列条件的同分异构体的结构简式。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| 溶解性 |
沸点 |
|
| A |
微溶于水 |
179.0℃ |
| E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是。
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式。
(2)A中m管的作用是;装置F的作用是。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是,C中应盛放的试剂是。
(4)E中若装有FeCl2溶液,反应的离子方程式为;E中若装有淀粉碘化钾溶液,能观察到的实验现象是。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是;实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是
照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(已知:4H++2 [Ag(S2O3)2]3- = Ag2S↓+3S↓+3SO2↑+SO42-+2H2O)
⑴操作Ⅲ的名称是;操作Ⅱ需要的主要玻璃仪器有。
⑵加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为。
⑶液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是。
⑷步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 。
。
⑸通过上述回收银的流程中,从绿色化学的要求看,存在的不足为。
四种短周期元素A、B、C、D的性质或结构信息如下:
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置,请写出BC2分子的电子式。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单 质与物质甲发生的反应。
质与物质甲发生的反应。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是 :
:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
①② ③。
③。
某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾,工业上常用浓硫酸吸收三氧化硫。
试回答:
(1)已知6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出9.83 kJ热量。反应的热化学方程式为____________________________________________________;
(2)A装置可用来观察二氧化硫和氧气的进气量。实验时使A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是___________________________;
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是________________________________。
(4)C装置用来收集三氧化硫,若用a g铜跟足量浓硫酸反应制二氧化硫,实验结 束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
(5)为了减轻实验对环境的污染,请你设计尾气处理装置,绘出装置图:
__________________________________________________________ 。
。