工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下: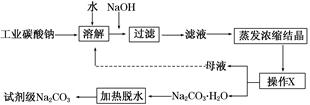
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ.有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液后过滤得到的滤渣中主要含有________(填写化学式)。25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(Mg2+)∶c(Fe3+)=________。
(2)操作X为________,其温度应控制在_____________________________________
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由______________________________
________________________________________________________________________。
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: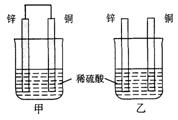
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的pH均增大 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
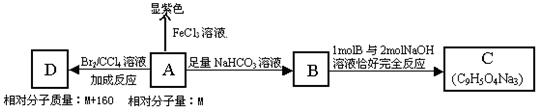
有A、B、C、D、E、F六种有机物,在一定条件下可发生如右图所示的转化关系。A可作为衡量一个国家石油化工发展水平的标志之一,A可氧化生成D,D与新制的Cu(OH)2悬浊液共热可生成一种砖红色沉淀,A与NaOH溶液共热得到C和无机盐NaX,在经硝酸酸化的NaX溶液中加入硝酸银溶液会产生淡黄色沉淀,燃烧等物质的量的这六种有机物,F燃烧产生的CO2的物质的量是其他有机物的2倍,只有C与E能与钠反应产生气泡。试推断:
⑴各物质的结构简式:A;B;C;D;E;F。
⑵C在浓硫酸作用下加热到170℃可制取A,写出该反应的化学方程式:
___________________________________。
⑶下列反应中属于氧化反应的是(填写序号)。
①D→E②D→C③E→F④C→D⑤F→E
已知G是合成某高分子化合物的原料,只含C、H、O三种元素,5.9g物质G能与1mol/LNaOH的溶液100mL恰好完全反应,0.1mol物质G与足量金属钠反应在标准状况下生成2.24L氢气,分子结构中含有一个甲基,A的分子式为C8H13O2Br,有机物A、B、C、D、E、F、G之间的相互转化关系如图所示:
⑴写出C的结构简式:.
⑵A中官能团名称是:.
⑶B的同分异构体中属于酯的有多种,任写其中三种属于酯类的结构简式:
,,.
⑷写出D→E化学反应方程式:.
⑸写出反应①化学反应方程式:
⑹写出由F和G 在一定条件下合成高分子化合物的化学反应方程式:
.
注射用双黄连以绿原酸为主要成分(其结构简式如图2)之一,绿原酸有着广泛的药理作用。已知一分子绿原酸在酸性条件下水解得到一分子咖啡酸A(环上有三个取代基,且不完全相邻)和一分子奎尼酸。某小组研究如下:
(1)奎尼酸的分子式为_____________。
(2)在图2中方框内补充完整绿原酸的结构
(3)写出咖啡酸与NaHCO3溶液反应的方程式_________ ____。
(4)写出符合下列4个条件的A的同分异构体E的结构简式_____ ________。
③FeCl3溶液反应显紫色②1molE分别能消耗2molNa、1molNaOH
③1molE与足量的新制Cu(OH)2反应可得到2molCu2O
④苯环上的一氯代物只有一种
(5)将一定量咖啡酸A与苯甲酸乙酯的混合物点燃。该混合物完全燃烧消耗x L O2,并生成y g H2O和一定量CO2(气体体积均为标准状况下的体积)。列出混合物中咖啡酸A 的物质的量计算式______________.
杜鹃素主要用于慢性支气管炎及其他痰多咳嗽病症,其结构简式如图所示,其中x、Y表示某种官能团或基团。请回答下列问题:
(1)杜鹃素的分子式可表示为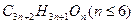 ,则杜鹃素的分为。
,则杜鹃素的分为。
(2)杜鹃素与足量氢氧化钠溶液完全反应,只生成一种有机化合物z和水,化合物Z的摩尔质量为366 g·mol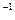 ,则杜鹃素分子中一Y的名称为。
,则杜鹃素分子中一Y的名称为。
(3)有机物A~H满足下列转化关系,芳香烃G的相对分子质量小于110,A与杜鹃素互为同分异构体。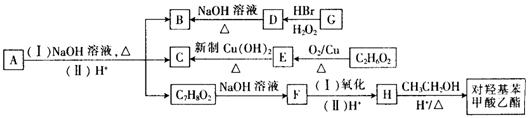
已知:CH3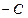 H
H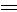 CH2+HBr
CH2+HBr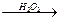 CH3CH2CH2Br
CH3CH2CH2Br
①G的名称为。
②反应D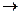 B的化学方程式为
B的化学方程式为 。
。
③A长期露置于空气中容易变质,从分子结构上看,A具有抗氧化作用,则A的结构简
式为。
④符合下列条件的对羟基苯甲酸乙酯的同分异 构体有种(对羟基苯甲酸乙酯自身除外)。
构体有种(对羟基苯甲酸乙酯自身除外)。
Ⅰ.苯环上含有两个对位取代基Ⅱ.能发生水解反应且能与FeCl3溶液发生显色反应