大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。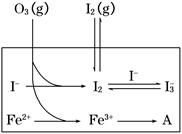
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
| 编号 |
反应物 |
反应前pH |
反应后pH |
| 第1组 |
O3+I- |
5.2 |
11.0 |
| 第2组 |
O3+I-+Fe2+ |
5.2 |
4.1 |
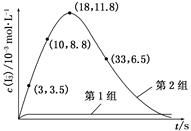
图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3 COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2H ClO ClO |
| B.CO2+H2O +NaClO = NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2 Na2CO3+2 C6H5OH C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是(填编号),其pH值为_______(填数值);pH最大的是(填编号)。
①HCN②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:
。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是,反应的离子方程式为。
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知
CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g) ;△Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ;△Hb =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)甲醇作为燃料,它的优点是燃烧时排放的污染物少,从而不仅能缓解能源紧张和温室效应的问题,还能改善大气质量。试利用(1)中的热化学方程式计算,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为kJ ,生成的CO2气体标准状况下体积是L
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在极反应;电极反应式为。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是(填序号)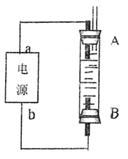
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化是,反应的化学方程式为。
已知反应:CO (g) + H2O(g) CO2 (g) + H2(g)
CO2 (g) + H2(g)
(1)将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/ 3的CO转化为CO2。则该反应平衡常数的表达式为______,此温度下平衡常数为。
3的CO转化为CO2。则该反应平衡常数的表达式为______,此温度下平衡常数为。
(2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较,
平衡应移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的(填编号)
| A.22.2% | B.27.55% | C.33.3% | D.36.8% |
(3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比 较,则下列说法中正确的是(填序号)
较,则下列说法中正确的是(填序号)
①生成物的产量一定增加 ②反应物的浓度一定降低
②反应物的浓度一定降低
③反应物的转化率一定增加④CO在平衡混合气中的百分含量一定降低
AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓
;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓 度,以(填“促进”、“抑制”)其水解。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
度,以(填“促进”、“抑制”)其水解。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
 (1))25OC时,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) c(CH3COO-)(填“ >” 或“=”或“<”,)。
(1))25OC时,将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) c(CH3COO-)(填“ >” 或“=”或“<”,)。
(2)25OC时, p H=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈(填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) c(CH3COO-)(填“ >” 或“=”或“<”,)。
H=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈(填“酸性”,“中性”或“碱性”),溶液中c(Na+ ) c(CH3COO-)(填“ >” 或“=”或“<”,)。