某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: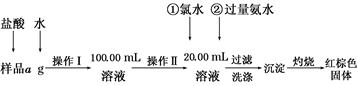
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
(8分,每空2分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。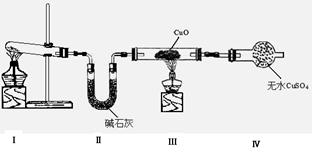
①装置Ⅰ中制取氨气 的化学方程式为。
的化学方程式为。
②装置Ⅲ、Ⅳ中的实验现象分别是:黑色CuO变为红色;白色无 水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。
请写出氨气与CuO反 应的化学方程式
应的化学方程式 ;
;
③装置Ⅱ中碱石灰的作用是。
(2)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu2O+2H+=" Cu" + Cu2+ +2H2O)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
。
(8分,每空2分)实验室要配制500mL2.0mol·L-1氯化钠溶液。请回答下列问题:
(1)应用托盘天平称取NaCl固体 g;
(2)下列仪器中,配制时一定不会用到的是(填字母) ;
A.量筒B.500 mL烧瓶
C.胶头滴管 D.500mL容量瓶
(3)除上述(2)中用到的仪器外,还缺少的玻璃仪器有 ;
(4)右图所示是某同学配 制溶液时最后两个步骤,按其操作定容,对所配溶液浓度有何影响? (填“偏高”、”偏低”或“无影响”);
制溶液时最后两个步骤,按其操作定容,对所配溶液浓度有何影响? (填“偏高”、”偏低”或“无影响”);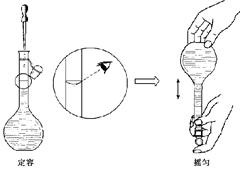
(10分)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙、丁四名同学进行F e(OH)3胶体的制备
e(OH)3胶体的制备
①甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,用玻璃棒搅拌,继续煮沸至溶液呈红褐色,停止加热。请评价该操作是否正确______________。
②乙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确____________。
(3)写出制备Fe(OH)3胶体的化学方程式:__________________________。
(4)怎样检验制备的物质是否为胶体?____________________________。
(5)取少量你制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是______________,这种现象称为胶体的____________。
(6)氢氧化铁胶体稳定存在的主要原因是__________。
A.胶粒直径小于1 nm B.胶粒带正电荷
C.胶粒作布朗运动 D.胶粒能透过滤纸
实验室用固体烧碱配制0.1mol×L-1的NaOH溶液500mL,回答下列问题:
(1)计算需要NaOH固体的质量g。
(2)有以下仪器和用品:①烧杯②药匙③250mL容量瓶④500mL容量瓶⑤玻璃棒 ⑥托盘天平。配制时,必须使用的仪器或用品有
⑥托盘天平。配制时,必须使用的仪器或用品有 (填序号),还缺少的仪器是。
(填序号),还缺少的仪器是。
(3)使用容量瓶前必须进行的一步操作是。
(4)配制时,一般分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却⑨振荡,其正确的操作顺序为。
(5)配制过程中,下列操作会引起结果偏 高的是(填序号)
高的是(填序号)
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容 时俯视刻度
时俯视刻度
(15分)下图是一套制取并验证氯 气部分化学性质的实验装置。
气部分化学性质的实验装置。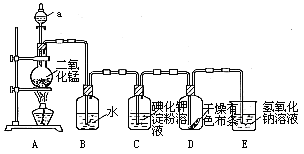
反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑回答下列问题:
MnCl2+2H2O+ Cl2↑回答下列问题:
(1)上述反应中氧化剂是____,还原剂是____。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式.
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为____色,反应的离子方程式为_,这个实验证明氯气的氧化性比碘单质____(填“强”或“弱”).
(4)当Cl2气流持续通过时装置D中干燥的有色布条能否褪色?为什么?
。
(5)装置E的作用是___。
(6)制取标况下氯气4.48升,至少需要MnO2克。(Mn-55,O-16)