2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,则吸入肺部CO的浓度不能超过______mol·L-1。
,则吸入肺部CO的浓度不能超过______mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
| T/℃ |
K1 |
K2 |
K3 |
| 700 |
1.47 |
2.38 |
0.62 |
| 900 |
2.15 |
1.67 |
|
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g) CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
A.缩小容器体积 B.降低温度
C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
IV |
IIV |
IIIV |
IVA |
VA |
VIA |
VIIA |
O |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,只有负价而无正价的元素是。
(2)还原性最强的单质是,氧化性最强的单质是。
(3)最高价氧化物对应的水化物中:酸性最强的物质是,呈两性的氧化物是
。
(4)在B、C、D、E、F、G、H中,原子半 径最大的是
径最大的是
由环己烷可制得1, 4 – 环己二醇,下列有7步反应(其中无机产物都已略去),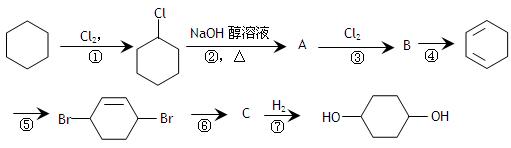
已知:二烯烃与卤素单质不完全加成有两种方式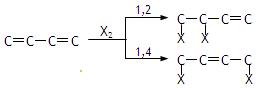
试回答:
(1) 反应属于取代反应。
(2) 化合物的结构简式 :B,C;
:B,C;
(3) 反应④所用试剂和条件是;
(4) 写出反应②、⑤的化学方程式:
反应②
反应⑤
(1)某烃中碳的质量分数为85.7%,1 mol该烃充分燃烧所生成的二氧化碳恰好被4mol/L氢氧化钠溶液1.5L完全吸收生成正盐,该烃能使溴水因反应而褪色,且在一定条件下还能发生加聚反应。则此烃的结构简式为____________________________;
(2)某烷烃碳架结构如图所示: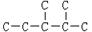 ,此烷烃的一溴代物有种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为: _______________________;若此烷烃为单烯烃加氢制得,则此烯烃的结构有种。
,此烷烃的一溴代物有种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为: _______________________;若此烷烃为单烯烃加氢制得,则此烯烃的结构有种。
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将作选的试剂及装置的编号填入表中。
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和NaHCO3溶液 e.新制CaO
分离操作:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 |
| 混合物 |
需加入的试剂 |
分离方法 |
| 1—氯丙烷(乙醇) |
||
| 乙烷(乙烯) |
||
| 乙醇(水) |
||
| 溴苯(溴) |
写出(1)乙炔的电子式:;(2)聚氯乙烯的结构 简式:
简式:
(3)苯和液溴反应生成溴苯的化学方程式: