将一块铝硅合金恰好与NaOH溶液完全反应而溶解。
(1)写出合金溶解的离子方程式______________________________________________。
(2)向所得的溶液中加入足量的盐酸,充分反应后,溶液中大量存在的离子为_______。
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l) + H2O (l)ΔH < 0。回答下列问题:
CO(NH2)2(l) + H2O (l)ΔH < 0。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1< 0
NH2COONH4(s) ΔH1< 0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号)。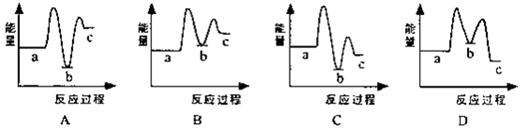
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)①从图中得知∆c(CO2)=0.2mol/L,则v(CO2)= ∆c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为。
②为提高尿素的产率,下列可以采取的措施有。
| A.缩小反应容器的容积 |
| B.升高温度 |
| C.平衡体系中及时分离出CO(NH2)2 |
| D.使用合适的催化剂 |
③该反应的平衡常数表达式K=;若升高体系的温度,容器中NH3的体积分数将
(填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。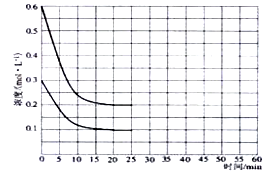
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体, 以上平衡将向______(填“正”、“逆”)向移动,理由是______________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向____(填“正”、“逆”)向移动,溶液中c(HA)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将______(填“增大”、“减小”或“不变”)。
(3)试设计实验方案证明HA为弱酸_______________________________________。
(1)图1装置发生反应的离子方程式为。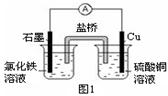
(2)图2装置中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。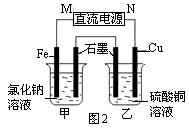
① 电源的M端为极,甲烧杯中铁电极的电极反应为。
② 乙烧杯中电解反应的化学方程式为。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为mL 。
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式,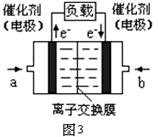
甲醇燃料电池的总反应化学方程式。
(1)家用液化气的主要成分之一是丁烷(C4H10),当2 mol丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5800kJ,试写出表示丁烷燃烧热的热化学方程式:;
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)ΔH =" -24.8" kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)ΔH =" -47.4" kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H =" +640.5" kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)和CO2(g)的热化学反应方程式。
(12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)=mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示):。
②混合溶液中离子浓度由大到小的顺序是:。
③混合溶液中由水电离出的c(H+)同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)=mol/L。