(1)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是 。从环保和经济角度考虑,上述尾气经处理可用作 。
(2)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式: ;
②写出“联合制碱法”有关反应的化学方程式: ;
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同? 。
T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如表格所示。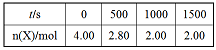
(1)前500s反应速率v(M)=_____,该反应的平衡常数K=_____。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填序号)
a.X的消耗速率与M的消耗速率相等 b.混合气体的平均相对分子质量不变
c.v(Y)与v(M)的比值不变 d.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。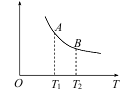
a.Y的逆反应速率
b.M的体积分数
c.混合气体的平均相对分子质量
d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
| A.平衡不移动 |
| B.重新达平衡后,M的体积分数小于50% |
| C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍 |
| D.重新达平衡后,Y的平均反应速率与原平衡不相等 |
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”),理由是_____。
I.H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为____________________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_______________。
A.c(Na+ )>c(K+) B.c(H +)•c(OH)=1×10-14
C.c(Na+ )=c(K+) D.c(Na+ )+c(K+ )=c(HA-)+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L的Cr2O72-。为使废水能达标排放,作如下处理:
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入__________g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe)=1×10-13mol/L,则残留的 Cr3+的浓度为__________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
某废液中含有大量的K+ 、Cl- 、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图: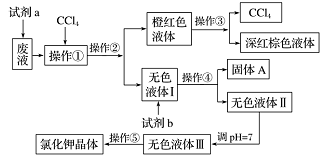
可供试剂 a、试剂 b(试剂 b代表一组试剂)选择的试剂:饱和 Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O溶液(H+)、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)操作⑤中用到的瓷质仪器名称是_____。
(2)操作①②③④⑤的名称是_____(填字母)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(3)试剂a应该选用__________,反应的离子方程式为_______________。
(4)除去无色液体Ⅰ中的Ca 2+、Mg2+、SO42-,选出试剂b所代表的试剂,按滴加顺序依次是_____(填化学式)。
(5)调节pH的作用是__________,涉及的化学方程式有_______________、_______________。
本题有两部分
I:软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.4g纯净MnO2最多能氧化____________L(标准状况)SO2。
(2)上述反应制得的溶液,调节pH值到5~7的范围,以除去Fe3+、 Al3+(使其浓度小于l×10-6mol·L-1),然后从得到的MnSO4和 MgSO4混合溶液中结晶MnSO4·H2O晶体,下图可以看出,需控制结晶温度在_______以上。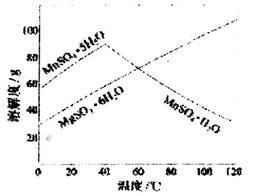
II:以磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见下图。清液pH>11时CaSO4转化的离子方程式_______________________
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为SO42-和_______(填化学式);检验洗涤是否完全的方法是____________。
(3)磷石膏若用氢氧化钠溶液溶解,发生反应的有关离子方程式为:
_________________________________ 、____________________________________
单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物.Y为氢化物,分子结构与甲烷相似,回答下列问题;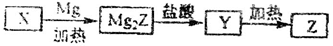
(1)能与X发生化学反应的酸是_______(写名称);由X制备Mg2Z的化学方程式为___ __。
(2)由Mg2Z生成Y的化学反应方程式为___________________,Y分子的电子式为________________
(3)Z、X中化学键的类型都是_________________。