常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
已知:Ⅰ.RCHO+R′CH2CHO
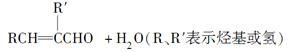
Ⅱ.醛与二元醇(如:乙二醇)可生成环状缩醛:
(1)A的核磁共振氢谱有两种峰。A的名称是_______________________。
(2)A与 合成B的化学方程式是____________________。
合成B的化学方程式是____________________。
(3)C为反式结构,由B还原得到。C的结构式是____________。
(4)E能使Br2的CCl4溶液褪色。N由A经反应①~③合成。
a.①的反应试剂和条件是________。
b.②的反应类型是________。
c.③的化学方程式是_____________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是________。
(6)碱性条件下,PVAc完全水解的化学方程式是___________________。
在浓硝酸中放入铜片:
(1)开始反应的化学方程式为_________________。
(2)若铜有剩余,则反应将要结束时的反应化学方程式是______________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因和离子方程式是_____。
。
(4)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________,
下图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是。
制取乙炔的化学方程式是。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是,乙炔发生了反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是,乙炔发生了反应。
(4)为了安全,点燃乙炔前应,乙炔燃烧时的实验现象是。
写出下列反应的化学方程式,并指出反应类型:
(1)乙炔与足量的溴水完全反应
(2)丙烯与氯化氢在一定条件下反应生成2—氯丙烷
(3)用乙炔制取聚氯乙烯
丁烷的分子结构可简写成键线式结构 ,有机物A的键线式结构为
,有机物A的键线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
,有机物B与等物质的量的H2发生加成反应可得到有机物A。则:
(1)有机物A的分子式为。
(2)用系统命名法命名有机物A,其名称为。
(3)有机物B可能的结构简式为:、、。
实验室用无水酒精和浓硫酸以1∶3的体积比混合加热制乙烯气体,请填写下列空白:
(1)写出制取乙烯的化学反应方程式_________。
(2)温度在170℃以上会使乙醇炭化,接着能发生氧化还原反应,生成二氧化碳、二氧化硫气体和水。试写出该反应的化学方程式。
(3)实验后期制得的乙烯气体中常含有杂质气体,将此混合气体直接通入溴水中能否证明乙烯发生加成反应的性质?__________(填“能“或“否”),原因是______________
。
(4)实验室制备乙烯所用浓硫酸主要作用是________。所用温度计水银球的位置是__________________。