A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题: 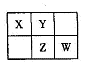
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3)AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是 。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式 。
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
(1)写出E、F形成化合物所含化学键的类型;A元素在周期表中的位置是
(2)D、E、F的最高价氧化物的水化物酸性强弱顺序(用化学式表示)
(3)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:
(4)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:、
(1)按系统命名法命名:
①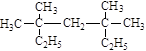 ;
;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
①2,3-二甲基-4-乙基已烷 :_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________;
(3)写出下列反应的化学方程式。
①实验室制乙烯。
②乙醇催化氧化 。
③2-氯丙烷消去反应 。
④乙醛与新制氢氧化铜 。
选考[化学一物质结构与性质]铜是应用较为广泛的有色金属。
(1)基态铜原子的核外电子排布式为。
(2)金属化合物Cu2Zn合金具有较高的熔点、较大的强度、硬度和耐磨度。Cu2Zn合金的晶体类型是。
(3)某含铜化合物的离子结构如图所示。
①该离子中存在的作用力有;
a.离子键
b.共价键
c.配位键
d.氢键
e.范德华力
②该离子中第二周期的非金属元素的第一电离能由大到小的顺序是;
③该离子中N原子的杂化类型有。
(4)铜与氧形成化合物的晶体结构如图。该化合物的化学式为,O的配位数是。
(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示。由图中数据分析,该反应的化学方程式为:。
(2)反应开始至2 min,Z的平均反应速率为。
(3)不同时间测得以下反应速率:
① v(X)="0.075" mol· L-1·min-1
② v(Y)="0.001" mol· L-1·s-1
③ v(Z)="0.06" mol·L-1·min-1
速率由大到小关系正确为
A.①>③>② B.③>①>② C.②>③>①
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B元素原子的最外层电子数为电子层数的两倍;E是地壳中含量最高的金属元素;C、F同主族,C元素核电荷数只有F元素的一半;1mol D单质跟水反应放出11.2L(标准状况)A气体单质。请回答下列问题:
(1)F在周期表中的位置是第周期第族
(2)C、D、F形成的某种常见化合物的晶体类型是(填“晶体类型”名称)
(3)由A、C、D、F四种元素形成的两种化合物(均含四种元素)能发生化学反应生成一种气体,请写出该反应的离子方程式___________。