根据右图回答以下问题:
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是 池,乙装置是 池且Fe极为 极,A极为 极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的体积(标准状况)为 L,
(10分) 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为。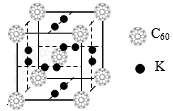
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为。
下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为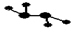 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为_________,D的化学式是_______。
②A、B、E中均含有的一种元素为___________ (填元素名称) 。
③E电子式为_________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______ _______。
⑤NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式。
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。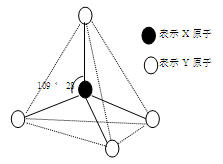
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式____________;与A同主族的第四周期元素基态原子的外围电子排布式为 。
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序(用元素符号回答)
(3)上述六种物质或粒子中互为等电子体的是(写出化学式)
(4)F分子的中心原子杂化类型是,E易溶于F,其原因是。
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于分子(填“极性”或“非极性”)。
(2)当n=3时,A与B形成的晶体属于晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是(用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态时核外电子排布式为,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为。
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。①Mn2+基态的电子排布式可表示为 ________。②NO3-的空间构型是________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。①根据等电子体原理,CO分子的结构式为________。②H2O分子中O原子轨道的杂化类型为________。③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为________。