【有机物化学基础】
肉桂酸甲酯( )又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
)又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
(1)有关肉桂酸甲酯的叙述中,正确的是 (填标号)。
A.肉桂酸甲酯的摩尔质量为163g/mol B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.能发生加聚反应生成高分子化合物
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。G的结构简式为 。
(3)用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有 (填名称)。
②B→C该反应的化学方程式为 。
③A→B、E→F的反应类型是 、 。
④符合下列条件的F的同分异构体的结构简式是 。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,l mol该物质与足量银氨溶液充分反应,生成4mol银单质。
、
、
、
是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
|
的基态原子
层电子数是
层电子数的2倍 |
|
| 的基态原子最外层电子排布式为: | |
|
存在质量数为23,中子数为12的核素 |
|
|
有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
⑴
位于元素周期表第周期第族,其基态原子最外层有个电子。
⑵
的电负性比
的(填"大"或"小");
和
的气态氢化物中,较稳定的是(写化学式)
⑶写出
与
反应的化学方程式,并标出电子转移的方向和数目:。
⑷在
原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:。氢元素、
、
的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:。
[化学一有机化学基础]
对二甲苯(英文名称
,缩写为
)是化学工业的重要原料。
(1)写出PX的结构简式。
(2)PX 可发生的反应有、(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中
是PX的一种同分异构体。
①
的苯环上存在2 种不同化学环境的氢原子,则
的结构简式是。
②
分子所含官能团是(填名称)。
③
分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)
是
的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
.遇
溶液显示特征颜色;
.能与碳酸氢钠溶液反应。
写出
与
溶液反应的化学方程式
(1)元素的第一电离能:
(填">"或"<")。
(2)基态
的核外电子排布式为。
(3)硅烷(
)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。
(4)硼砂是含结晶水的四硼酸钠,其阴离子
(含
三种元素)的球棍模型如图所示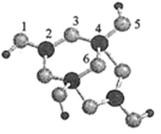
①在
中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);
=(填数字)。
②硼砂晶体由
、
和
构成,它们之间的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(1)电镀时,镀件与电源的极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用(填"氧化剂"或"还原剂")与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:

(3)酸浸法制取硫酸铜的流程示意图如下

① 步骤(i)中
发生反应的化学方程式为。
② 步骤(ii)所加试剂起调节
作用的离子是(填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol
转移2 mol 电子,该反应的离子方程式为。
④ 步骤(iv)除去杂质的化学方程式可表示为:
过滤后母液的 , , , ,该反应的平衡常数K=(用含a 、b 、d 的代数式表示)。
(1)元素
的离子与
所含电子数和质子数均相同,则
的原子结构示意图为。
(2)硫酸铝溶液与过量氨水反应的离子方程式为。
(3)能证明
溶液中存在
 水解平衡的事实是(填序号)。
水解平衡的事实是(填序号)。
A.滴人酚酞溶液变红,再加人
溶液后红色退去
B.滴人酚酞溶液变红,再加人氯水后红色退去
C.滴人酚酞溶液变红,再加人
溶液后产生沉淀且红色退去
(4)元素
、
在周期表中位于向一主族,化合物
和
可发生如下转化(其中
是纤维素水解的最终产物):
① 非金属性
(填">"或"<")
②
与过量浓硝酸反应有红棕色气体生成,化学方程式为
(5)在恒容绝热(不与外界交换能量)条件下
 反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
| 物质 |
||||
| 起始投料/ | 2 |
1 |
2 |
0 |